时间:2017-07-10 19:29:27
1、选择题 下列用电子式表示化合物的形成过程,正确的是
[? ]
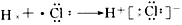
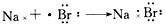
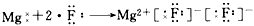
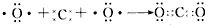
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是( )
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越少,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫离子键
参考答案:C
本题解析:略
本题难度:简单
3、简答题 下列物质含有非极性共价键的共价化合物是( )
A.H2O2
B.HCl
C.Na2O2
D.Cl2
参考答案:A、H2O2既含有非极性共价键,又含有极性共价键,属于共价化合物,故A正确;
B、HCl为共价化合物,只含有性共价键,故B错误;
C、Na2O2既含有非极性共价键,又含有离子键,为离子化合物,故C错误;
D、Cl2为非金属单质,只含有非极性共价键,不属于化合物,故D错误.
故选A.
本题解析:
本题难度:一般
4、推断题 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
(1)E、G、M的第一电离能由大到小的顺序为 ??。
(2)下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价。基态R2+的核外电子排布式为??;Q的化合价为 ??价。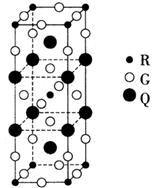
(3)1 mol晶体L中含有δ键的数目为 ??。
(4)G与M可形成MG3与MG2,MG3分子的空间构型是??,MG2中M原子的杂化方式是?。
(5)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有??(填字母)。?
a.离子键? b. 氢键? c.配位键? d.金属键?
参考答案:
(1)N>O>S?(2)[Ar]3d9? +3?(3)2NA?
(4)平面三角型? sp2杂化
(5)ac
本题解析:A、D、E、G、L、M、R分别为H、C、N、O、Si、S、Cu。(1)N最外层电子为半满的相对稳定结构,第一电离能比相邻元素高,故有N>O>S;
(2)晶胞中G数目16×1/4+4×1/2+2=8
R数目8×1/8+1=2
Q数目8×1/4+2= 4
故化学式为G4Q2R,所以Q的化合价为+3
(3)1 mol晶体L中含有δ键的数目为2NA;硅晶体为原子晶体,1mol含有2molSi-Si键;(4)SO3和SO2中价电子对数为6/2=3,SO3中S的杂化为sp2,故为平面三角型;SO2中S的杂化方式为sp2;(5)含有配位键和离子键。
本题难度:一般
5、选择题 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若W原子的最外层电子数是内层电子总数的
| 7 10 |
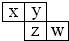
参考答案:X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的710,则W原子其内层电子总数为10,最外层电子数为7,故W是Cl元素;由X、Y、Z、W在周期表中的位置关系可知,Z为S元素;Y为O元素;X为N元素.
A、核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径X>Y,Z>W;最外层电子数相同,电子层越多半径越大,所以W>X,所以阴离子半径由大到小排列顺序Z>W>X>Y,故A错误;
B、X为N元素,Y为O元素,氮元素与氧元素的电负性很强,氨气与水中都存在氢键,故B正确;
C、Y为O元素,常见的两种同素异形体氧气与臭氧,空气中有大量的氧气,故二者在常温下不能相互转化,故C错误;
D、同周期元素从左到右元素的非金属性逐渐增强,所以非金属性W>Z,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性:W>Z,故D错误.
故选:B.
本题解析:
本题难度:一般