时间:2017-07-10 19:27:14
1、填空题  (10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中D是正确的,混合后溶液中的溶质为 。
(3)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则混合前a b(填“>”、“<”、或“=”), 用a、b表示NH3·H2O的电离平衡常数为 。
参考答案:(1)NH4Cl ,A (2) NH4Cl NH3·H2O (3) > b·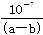 ·mol·L-1
·mol·L-1
本题解析:任何水溶液中均存在OH-和H+,所以去掉OH-和H+,剩下的离子就是溶质产生的,因此①中溶质为氯化铵。而此溶液中,因为NH4+水解,所以c(Cl-)>c(NH4+)>c(H+)>c(OH-),即答案选A。(2)要变为D选项,就要增大c(NH4+),所以要在NH4Cl溶质的基础上加NH3·H2O,所以溶质为NH4Cl和NH3·H2O。)(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,氨水过量,则混合前a >b,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)= mol/L,混合后反应前c(NH3?H2O)=
mol/L,混合后反应前c(NH3?H2O)=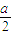 mol/L,则反应后c(NH3?H2O)=(
mol/L,则反应后c(NH3?H2O)=(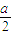 -
- )mol/L,
)mol/L,
则k= 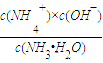 =
= 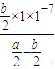 =
= 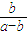 ×10-7。
×10-7。
考点:考查盐类水解。
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.同一条件下,不同物质的量浓度的氨水的电离程度是相同的?
B.在95℃时,纯水的pH小于7?
C.反应能否自发进行只与温度有关?
D.能自发进行的化学反应,一定是△H>0、△S>0
参考答案:B
本题解析:
本题难度:简单
3、选择题 (12分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物 质的量浓度相同时
质的量浓度相同时 ,三种溶液中水的电离程度由大到小的顺序是____________.(用a、b、c表示,下同)
,三种溶液中水的电离程度由大到小的顺序是____________.(用a、b、c表示,下同)
(2)同体积、同物质的量浓度的三种酸,中和N aOH的能力由大到小的顺序是___________.
aOH的能力由大到小的顺序是___________.
(3)当三者c(H+)相同时,物质的量浓度由大到小的顺序是__________________.
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________ __________.
__________.
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则反应所需时间的长短关系是______________________.
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后 ,c(H+)由大到小的顺序是_________________.
,c(H+)由大到小的顺序是_________________.
参考答案:(12分,每空2分) (1)c>a>b  (2)b>a=c (3)c>a>b
(2)b>a=c (3)c>a>b
(4)c>a=b (5) a=b>c (6)c>a=
本题解析:略
本题难度:一般
4、选择题 相同温度下,两种氨水A、B,浓度分别是0.2?mol/L和0.1?mol/L,则A和B的OH-浓度之比
[? ]
A.大于2?
B.小于2?
C.等于2?
D.不能确定
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列变化中证明硫酸是强酸的是
A.和铜反应
B.和锌反应放出H2
C.与NaCl反应制HCl
D.与Ca3(PO4)2反应制H3PO4
参考答案:D
本题解析:强酸制弱酸,说明硫酸是强酸,D正确。而A是利用了硫酸的强氧化性,B只能证明硫酸具有酸性;C是利用了HCl的挥发性。
本题难度:一般