时间:2017-07-10 19:25:21
1、填空题 聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
聚合过程主要利用了Al3+的性质是?。
参考答案:水解性
本题解析:略
本题难度:简单
2、选择题 为使Na2S溶液中
| c(Na+) c(S2-) |
参考答案:在硫化钠溶液中电离出钠离子和硫离子,硫离子水解方程式为:S2-+H2O?HS-+OH-,要使c(Na+)c(S2-)的值减小,需使硫离子水解平向逆方向移动即可.
A、加盐酸会使得平衡正向移动,不合题意,故A错误;
B、加适量KOH溶液,c(OH-)增大,硫离子水解平向逆方向移动,c(S2-)增大,比值减小,符合题意,故B正确;
C、加适量NaOH溶液,c(OH-)增大,硫离子水解平向逆方向移动,c(S2-)增大,此时c(Na+)也要增大,但是钠离子增大的程度比硫离子增加的程度大,所以比值增大,不合题意,故C错误;
D、加入适量的醋酸钠,钠离子浓度增大,醋酸酸根离子水解会导致平衡逆向移动,硫离子浓度增大,但是钠离子增大的程度比硫离子增加的程度大,所以比值增大,不合题意,故D错误;
故选B.
本题解析:
本题难度:一般
3、填空题 常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):?。
(2)混合溶液中由水电离出的c(OH-)?(填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=?mol·L-1,c(OH-)-c(HA)=?mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH?7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3?B.NH4A? C.(NH4)2SO4?D.NH4Cl
按pH由大到小的顺序排列是?(填序号)。
参考答案:(1)A-+H2O HA+OH-
HA+OH-
(2)>
(3)9.9×10-7 10-8
(4)> A>B>D>C
本题解析:(2)混合溶液由于A-水解,促进水的电离,而NaOH抑制水的电离。
(3)一开始c(Na+)=c(A-),但Na+不水解,A-水解,c(Na+)与c(A-)之差即为水解的A-的量。pH=8,c(H+)=10-8 mol·L-1,c(OH-)=10-6 mol·L-1。
由H2O电离的c(OH-)H2O=c(H+)=10-8 mol·L-1
A-+H2O HA+OH-
HA+OH-
则c(Na+)-c(A-)=c(OH-)-c(OH-)H2O=9.9×10-7 mol·L-1
c(OH-)-c(HA)=10-6 mol·L-1-9.9×10-7 mol·L-1=10-8 mol·L-1
(4)NH4A溶液为中性,说明NH4+与A-的水解程度相当,而HA加到Na2CO3中有气体放出,说明HA酸性强于H2CO3,CO32-水解程度大于A-,因而(NH4)2CO3溶液pH>7,NH4HCO3溶液的pH也同样大于7。Cl-和SO42-不水解,所以(NH4)2SO4和NH4Cl溶液显酸性,但(NH4)2SO4中NH4+更多,水解程度更大,因而pH[(NH4)2SO4]<pH(NH4Cl)<7=pH(NH4A)<pH(NH4HCO3)。
本题难度:一般
4、选择题 常温下某溶液中只含有Na+、H+、OH—、A—四种离子,下列说法正确的是
A.若溶质为NaA和HA,则一定存在c(A—)>c(Na+)>c(H+)>c(OH—)
B.若c(OH—)>c(H+),溶液中不可能存在c(Na+)>c(OH—)>c(A—)>c(H+)
C.溶液中可能存在c(Na+)>c(A—)>c(H+)>c(OH—)
D.若溶质为NaA,溶液中可能存在:c (OH—)=c(H+)+c(HA)
参考答案:D
本题解析:溶液中必然存在如下电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(A-),A项,因NaA和HA浓度未知,故无法确定具体离子浓度大小;B项,c(OH-)>c(H+),由电荷守恒可知c(Na+)>c(A-),若c(OH-)很大,可能出现c(OH-)>c(A-);C项,电荷不守恒;D项,是溶液中存在的质子守恒式。
本题难度:一般
5、选择题 下列各种溶液粒子物质的量浓度关系正确的是()
A.0.1mol·V的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(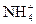 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.0.2mol·L-1Na2CO3溶液:c(OH-)=c(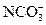 )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
C.0.2mol·L-1(NH4)2SO4溶液:c(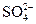 )>c(
)>c(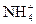 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.0.2mol·L-1NaHCO3溶液:c(Na+)>c(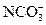 )>c(
)>c(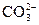 )>c(OH-)
)>c(OH-)
参考答案:B
本题解析:选项A
NH4Cl+NaOH====NaCl+NH3·H2O
0.050.050.050.05
溶液的酸碱性取决于NH4Cl和NH3·H2O,其可能性有三种:NH4Cl水解程度>NH3·H2O电离程度,呈酸性;反之,呈碱性;相当,则呈中性。故无法选择。
选项B有两种解法:
方法一:电荷守恒+物料守恒
c(Na+)+c(H+)=c(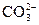 )×2+c(
)×2+c(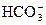 )×1+c(OH-)①
)×1+c(OH-)①
c(Na+)=2c(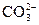 )+c(
)+c(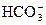 )+c(H2CO3)②
)+c(H2CO3)②
②-①整理得:c(OH-)=c(H+)+c(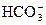 )+?2c(H2CO3)
)+?2c(H2CO3)
方法二:质子在H2O与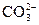 之间传递
之间传递
因左右两边的质子数守恒,且等量代换,
故:c(OH-)=c(H+)+c(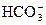 )+2c(H2CO3)。
)+2c(H2CO3)。
选项C,一定是c(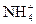 )>c(
)>c(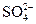 )。
)。
选项D,一定是c(OH-)>c(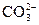 ),因
),因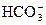 的电离程度<水解的程度。
的电离程度<水解的程度。
本题难度:简单