时间:2017-07-10 19:24:14
1、选择题 断开1mol?AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A-B的键能.已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,则N≡N的键能是( )
A.431?kJ/mol
B.945.6?kJ/mol
C.649?kJ/mol
D.869?kJ/mol
参考答案:B
本题解析:
本题难度:简单
2、选择题 已知
(1) △H1=a kJ/
△H1=a kJ/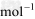
(2)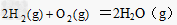 △H2=a kJ/
△H2=a kJ/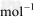
(3) △H3=a kJ/
△H3=a kJ/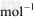
(4) △H4=a kJ/
△H4=a kJ/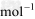
下列关系式中正确的是
[? ]
A.a<c <0?
B.b>d>0?
C.2a=b<0?
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
3、选择题 用3克块状大理石与30毫升3mol·L-1的盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是
①再加入30毫升3摩/升盐酸 ? ②改用30毫升6摩/升盐酸? ③改用3克粉末状大理石 ? ④适当升高温度
A.①②④
B.②③④
C.①③④
D.①②③
参考答案:B
本题解析:反应速率与盐酸的用量多少无关,只与盐酸的浓度有关;改用粉末状的大理石,能增大反应的接触面积,使反应速率加快;升高温度,化学反应速率加快。
本题难度:一般
4、填空题 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______________________________________。
(2)已知H2O(l)== H2O(g) ΔH=+ 44kJ·mol-1,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
_______________________________________________。
参考答案:(1)N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) ΔH=6 41.625kJ·mol-1
(2)408.8
(3)燃烧产物不污染环境
本题解析:
本题难度:一般
5、选择题 已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(g);△H= - Q2 kJ/mol,
2H2( g)+O2(g) =2H2O(l);△H= - Q3kJ/mol。
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则 放出的热量为
[? ]
A.0.4Q1+0.05Q3
B.0.4Q1+0.05Q2
C.0.4Q1 +O.1Q3
D.0.4Q1+0.2Q2
参考答案:A
本题解析:
本题难度:一般