时间:2017-07-10 19:23:52
1、选择题 根据现行元素周期表的排布规律,如果第七周期排满,下列预测正确的是
[? ]
A.第七周期共有50种元素
B.第七周期最后一种元素不与任何物质发生反应
C.第七周期ⅦA族元素的原子在化学反应中可以得到1个电子
D.第七周期任何一种元素的原子最外层上不超过8个电子
2、选择题 对于核电荷数为37的元素,下列描述正确的是
A.原子半径比钾原子半径小
B.其单质常温下跟水反应不如Na剧烈
C.碳酸盐易溶于水
D.氢氧化物不能使Al(OH)3溶解
3、选择题 X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在在适当条件下可发生如下变化,其中B和C均为10电子分子。下列说法中不正确的是? 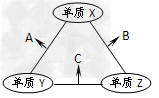
[? ]
A.X元素位于ⅥA?
B.B的沸点大于C的沸点
C.A能溶解于B中?
D.A和C不可能发生氧化还原反应
4、简答题 某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表.
?实验操作
5、推断题 A、B、C、D、E、F六种元素的原子序数依次增大,A元素的原子核外电子数、电子层数和最外层电子 数均相等。B、C、D位于同一周期,B原子的最外层电子排布式为2s22p2,基态D原子核外有2个未 成对电子。E的一种化合物是必备的调味品,且E元素的单质能与水反应生成两种酸。甲、乙、M、 W、X、Y、Z七种物质均由A、C、D三种元素中的一种或两种或三种组成(只有M分子同时含有三种 元素),其中甲、乙为非金属单质,W由A和C组成,其分子中含有18个电子,X分子中含有10个电子,F 的单质及其化合物的颜色有红色、黑色、蓝色、白色、棕黄色等。它们之间的相互转化关系如图所示。 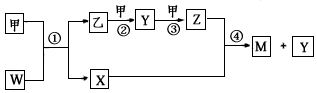
(1)元素A和B形成原子个数之比为1:1的相对分子质量最小的化合物分子中含σ键与π键的数目之比为____。
(2)F与D组成红色固体化合物,写出该化合物中基态F离子的电子排布式:____。
(3)A分别与B、C、D、E形成共价化合物,其中共价键键长最长的是__,键的极性最大的是 ___。(用化学用语表示)
(4)选择A、B、C、D四种元素的原子组成符合下列立体结构或性质的分子,写出化学式。平面结构: ___,能形成分子间氢键:___。
(5)已知P4、CA4+、C4A44+的空间构型均为正四面体,用“→”表示共用电子对由某原子单方面提供(配位键)。白磷( P4)的结构式为 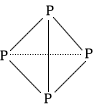 ,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。
,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。