时间:2017-07-10 19:18:43
1、选择题 在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
A.硅酸钠溶液
B.氯化钡溶液
C.石灰水
D.漂白粉溶液
参考答案:B
本题解析:弱酸不会制强酸
本题难度:一般
2、计算题 在25 ℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中V(CO)________=L,V(H2)=______L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则原a的取值范围是________。
参考答案:(1)5? 5? (2)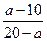 ?(3)10<a<20
?(3)10<a<20
本题解析:(1)设混合气中CO为x L。
2CO+O2 2CO2?减少1
2CO2?减少1
X?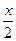
2H2+O2 2H2O(l)?减少3
2H2O(l)?减少3
(10-x)?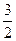 (10-x)
(10-x)
因为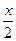 +
+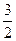 ?(10-x)=(10+15)-15,
?(10-x)=(10+15)-15,
解得x="5L?" 10-x="5" L
(2)同理下列方程式: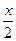 +
+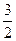 ?(10-x)=(10+15)-a
?(10-x)=(10+15)-a
解得:x="a-10L?" 10-x=(20-a)L
所以V(CO)∶V(H2)= 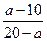
(3)因为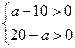
所以10<a<20
本题难度:简单
3、填空题 (1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后,H2O一般写在最后):
①镁橄榄石(Mg2SiO4):___________________________________________________________;
②高岭石〔Al2(Si2O5)(OH)4〕:_____________________________________________________。
(2)许多含氧酸及其盐类均可以类似地改写为氧化物形式,请继续改写以下物质:
HNO3____________;HCOOH_________________;
KAl(SO4)2·12H2O____________________________。
通过以上改写可知,HNO3的酸酐为__________,HCOOH与H2SO4反应可制________气体。
(3)已知在一定条件下,Fe在Cl2中燃烧可以生成Fe3Cl8,它可以看作是FeCl2·2FeCl3。类似地,碘与Fe在一定条件下可得到Fe3I8,则它可以看作是________________。
参考答案:(1)①2MgO·SiO2
②Al2O3·2SiO2·2H2O
(2)N2O5·H2O? CO·H2O? K2O·Al2O3·4SO3·24H2O? N2O5? CO
(3)3FeI2·I2
本题解析:改写时注意中心元素的化合价不变,同时不能出现分数,不够时可在前面加计量数,如HNO3可视为2HNO3写作N2O5·H2O。对(3)因Fe3+与I-不能共存,故不能写成FeI2·2FeI3。
本题难度:简单
4、填空题 有A、B、C三种透明、不溶于水的坚硬固体。A在O2中完全燃烧只得到一种无色气体,此气体的密度为O2密度的1.375倍(标准状况)。B能溶于热烧碱溶液中,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,它是一种比碳酸还弱的酸,分离出此沉淀物,经干燥后得到不溶于水的白色粉末,将B与石灰石、纯碱按一定比例混合高温烧熔、冷却得C,C在高温下软化,无固定熔点。根据以上事实,推断:
(1)A是________,B是________,C是________。
(2)写出有关反应的化学方程式________________________________。
参考答案:(1)金刚石晶体?二氧化硅晶体?玻璃
(2)C+O2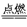 CO2?SiO2+2NaOH
CO2?SiO2+2NaOH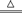 Na2SiO3+H2O
Na2SiO3+H2O
Na2SiO3+2HCl H2SiO3↓+2NaCl
H2SiO3↓+2NaCl
CaCO3+SiO2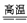 CaSiO3+CO2↑
CaSiO3+CO2↑
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
本题解析:A完全燃烧所得气体的相对分子质量为:32×1.375=44,即该气体为CO2,A为C元素的单质,依A的性能知A为金刚石,依据B的性质及所发生的一系列反应和反应产物的性质推知B为SiO2晶体,则C为玻璃。
本题难度:简单
5、选择题 往含0.2 mol NaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)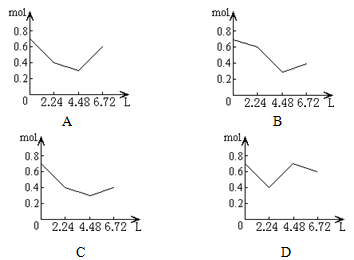
参考答案:C
本题解析:反应的先后顺序,可以看成Ca(OH)2,先反应生成CaCO3沉淀,然后与NaOH反应生成Na2CO3,再生成NaHCO3,最后CaCO3溶解生成Ca(HCO3)2。故答案C正确
本题难度:简单