时间:2017-07-10 19:13:09
1、选择题 25℃时,将浓度为0.1mol·L-1的醋酸溶液加水稀释10倍,浓度变化最大的微粒是
A.CH3COO-
B.H+
C.OH-
D.CH3COOH
参考答案:D
本题解析:醋酸溶液中存在如下电离平衡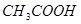 ?
?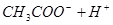 ,加水稀释,假设平衡不移动,则溶液中各粒子浓度变化倍数相同,但加水稀释平衡向右移动,所以醋酸分子浓度再次减少,即正确选项为D;
,加水稀释,假设平衡不移动,则溶液中各粒子浓度变化倍数相同,但加水稀释平衡向右移动,所以醋酸分子浓度再次减少,即正确选项为D;
本题难度:一般
2、选择题 下列叙述正确的是?(?)
A.某电解质溶于水后,其导电能力不强,则此电解质必定是弱电解质
B.SO 溶于水后,所得溶液导电性很好,故SO
溶于水后,所得溶液导电性很好,故SO 是强电解质
是强电解质
C.共价化合物都是弱电解质
D.弱电解质溶液中,同时存在着电解质电离出来的离子及未电离的分子
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列各反应的反应式或离子方程式中,能够说明次氯酸是弱电解质的是()
A.次氯酸光照下分解:2HClO 2HCl+O
2HCl+O ↑
↑
B.次氯酸钙溶液中通入适量二氧化碳气体产生白色沉淀:
Ca(ClO) +CO
+CO +H
+H O
O CaCO
CaCO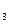 ↓+2HClO
↓+2HClO
C.次氯酸与氢氧化钠中和:
HClO+NaOH NaClO+H
NaClO+H O
O
D.次氯酸与H SO
SO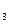 作用:
作用:
HClO+H SO
SO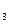
 H
H SO
SO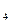 +HCl
+HCl
参考答案:B
本题解析:A中HClO见光分解,显示其不稳定性;B中碳酸是弱酸,Ca(ClO) 中通入二氧化碳产生HClO,说明HClO酸性比碳酸更弱;C中显示其酸性;D中显示其氧化性。
中通入二氧化碳产生HClO,说明HClO酸性比碳酸更弱;C中显示其酸性;D中显示其氧化性。
本题难度:一般
4、填空题 (1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
参考答案:(1) < (2) > (3) 不变 (4)减小
本题解析:(1)由于氨水是弱电解质,所以在PH值相同的情况下。氨水消耗酸的体积比较大。(2)由于醋酸是属于弱酸,所以在PH值相同的情况下,醋酸的浓度大于硫酸。(3)溶解平 衡常数只与温度有关。所以Ksp(AgCl)不变。(4)加入氯化铵之后,铵根离子增加。反应向氨水的电离的反方向移动,所以氨水的电离程度减小
考点:考查弱电解质的相关知识点
本题难度:一般
5、填空题 为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
(2)乙取出10 mL 0.10 mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000 mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是?(用等式或不等式表示)。
(3)丙取出10 mL 0.10 mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质??。(填“能”或“不能”)
(4)丁用pH试纸来测定0.10 mol/L醋酸钠溶液的pH,发现0.10 mol/L醋酸钠溶液的pH为9,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
参考答案:(1)正确? (2)b<a+2? (3)能? (4)正确
本题解析:(1)正确,若醋酸为强酸,则其溶液的pH=1,现醋酸溶液pH=4,说明醋酸没有完全电离,存在电离平衡。
(2)假设如果它是强酸,稀释100倍,溶液的pH=a+2,因为它是弱酸,故pH<a+2。
(3)能,加入醋酸钠晶体,颜色变橙色,说明溶液的酸性变弱,CH3COO-抑制了醋酸的电离,故醋酸为弱电解质。
(4)正确,由题意知,醋酸钠溶液呈碱性,说明醋酸钠中的醋酸根离子发生了水解,故醋酸为弱酸
本题难度:一般