时间:2017-07-10 19:10:56
1、计算题 (6分)、0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量是多少摩尔?
参考答案:0.16mol
本题解析:溶液中铁离子和铜离子的物质的量分别都是0.24mol。由于铜离子的氧化性弱于铁离子的,所以首先是铁离子氧化单质铁,方程式为2Fe3++Fe=3Fe2+;
如果铁离子完全反应,则生成亚铁离子是0.36mol,此时溶液中Fe2+与Cu2+物质的量之比为3︰2,这说明溶液中铁单质也和铜离子反应,方程式为Fe+Cu2+=Fe2++Cu。
设和铜离子反应的单质铁是x,则消耗铜离子是x,生成亚铁离子是x,所以有(x+0.36mol)/(0.24mol-x)=2,解得x=0.04mol,
所以加入的铁粉是0.12mol+0.04mol=0.16mol
本题难度:一般
2、选择题 要鉴定某溶液中所含的一种阳离子为Fe2+(且未被氧化),最好的方法是
A.加人NaOH溶液
B.先加入KSCN溶液再加氯水
C.先加氯水再加KSCN溶液
D.加入锌片
参考答案:B
本题解析:先加入KSCN溶液显红色证明有Fe3+,,再加氯水显红色证明有Fe2+转换为Fe3+
本题难度:简单
3、选择题 将过氧化钠投入FeCl2溶液中,可观察到的实验现象是(?)
A.有可燃性气体产生
B.没有沉淀生成
C.有红褐色沉淀生成
D.有白色沉淀生成
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。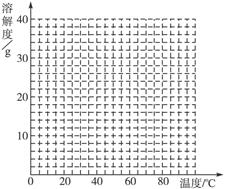
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
参考答案:(1)除油污?升高温度,溶液碱性增强,去油污能力增强
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在
(3)洗涤除去晶体表面附着的硫酸等杂质
用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗
(4)如图
(5)56.7 ℃<t<64 ℃
本题解析:(1)Na2CO3溶液的主要作用是除去废铁屑表面的油污,因为升高温度,Na2CO3的水解程度大,去污能力强,故需加热。
(2)Fe2+易被空气中的O2氧化成Fe3+,要保证得到较纯净的FeSO4·7H2O晶体,必须在溶解铁屑时保证铁屑过量。
(3)要得到纯净的FeSO4·7H2O晶体,在滤出晶体后必须洗涤2~3次,以除去其表面的杂质离子。
本题难度:简单
5、选择题 下列试剂中能用来区分Fe2+和Fe3+的是
A.KSCN
B.FeCl3
C.H2SO4
D.NH4Cl
参考答案:A
本题解析:向溶液中滴加KSCN,如果溶液变为血红色,证明含有Fe3+,Fe2+遇KSCN不变色,所以,可以用KSCN区分Fe2+和Fe3+,故选A。
本题难度:简单