时间:2017-07-10 19:06:06
1、选择题 已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2 ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 
[? ]
A.CO的燃烧热为283kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
2、选择题 下列化学式表示的粒子对H2O的电离平衡不产生影响的是
A.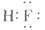
B.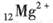
C.
D.
3、填空题 (1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液?②20毫升0.50mol/L硫酸水溶液?③30毫升0.40mol/LHCl溶液?④40毫升0 .30mol/LCH3COOH水溶液?⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________?_。
.30mol/LCH3COOH水溶液?⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________?_。
(2)水的电离平衡如图所示.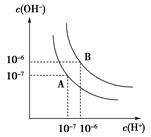

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为?。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为?。
③已知AnBm的离子积=c(Am+)n?c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为?。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是?。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H?2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示)?,
验证纯碱溶液呈碱性的实验方法(简述操作过程):?。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)? ?。
?。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
4、选择题 0.1 mol?L-1 KHS溶液中下列表达式不正确的是( )
A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
5、选择题 下列热化学方程式中的反应热下画线处表示燃烧热的是
[? ]
A.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H= -akJ/mol
B.CH3CH2OH(l)+1/2O2(g)=CH3CHO(l)+H2O(l) △H=-bkJ/mol
C.CO(g)+1/2O2(g)=CO2(g) △H=-ckJ/mol
D.NH3(g)+5/4O2(g)=NO(g)+6/4H2O(g) △H=-dkJ/mol