时间:2017-07-10 18:55:26
1、选择题 下表是常温下某些一元弱酸的电离常数:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-4 |
参考答案:C
本题解析:对于一元弱酸,电离平衡常数越大,酸性越强,PH越小,pH由大到小的顺序是HCN>CH3COOH>HNO2>HF选C。
考点:考查电离平衡常数的应用和pH的有关计算。
本题难度:一般
2、选择题 将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
[? ]
A.c(H+)
B.Ka(HF)
C.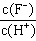
D.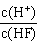
参考答案:D
本题解析:
本题难度:一般
3、填空题 能说明醋酸是弱电解质的是
A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液
B.用食醋可以除热水瓶内的水垢
C.pH=2的醋酸溶液稀释1000倍后pH小于5
D.用浓H2SO4和醋酸钠固体共热可制得醋酸
参考答案:C
本题解析:略
本题难度:一般
4、选择题 在HNO2溶液中存在如下平衡:HNO2?H++NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是( )
A.NaOH溶液
B.硫酸溶液
C.NaNO2溶液
D.NaHSO4溶液
参考答案:A
本题解析:
本题难度:简单
5、填空题 (1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
参考答案:(1) < (2) > (3) 不变 (4)减小
本题解析:(1)由于氨水是弱电解质,所以在PH值相同的情况下。氨水消耗酸的体积比较大。(2)由于醋酸是属于弱酸,所以在PH值相同的情况下,醋酸的浓度大于硫酸。(3)溶解平 衡常数只与温度有关。所以Ksp(AgCl)不变。(4)加入氯化铵之后,铵根离子增加。反应向氨水的电离的反方向移动,所以氨水的电离程度减小
考点:考查弱电解质的相关知识点
本题难度:一般