时间:2017-07-10 18:54:43
1、填空题 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=_______ _____。
②下列各项中,不能够说明该反应已达到平衡的是___________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变△H____0(填“>” “<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是________。
a.升高温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=____kJ/mol
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。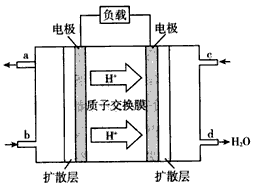
①该电池工作时,b口通入的物质为____,c口通入的物质为_______________
②该电池正极的电极反应式为:_________________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有____NA个电子转移。
(5)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):________________ 
2、填空题 用离子方程式表示下列化学变化:
(1)电解氯化钠溶液____________________________________________
(2)电解硝酸银溶液____________________________________________
3、选择题 下列说法正确的是
A.金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼
B.原电池中电子从负极经过溶液流向正极
C.电解池中电解质溶液的阳离子向阴极迁移
D.在铁制品上镀银,铁做正极,银做负极
4、简答题 氯碱工业是化学工业基础,目前我国大多采用立式隔膜电解槽电解食盐水.电解饱和食盐水的化学方程式:2NaCl+2H2O
5、填空题 某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是?。(写化学式)
(2)写出第③步反应的离子方程式?。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有?。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为?。
为d,则此时的铬酸钾的转化率为?。