时间:2017-07-10 18:35:21
1、实验题 [2012·潍坊一模] (14分)黄铜矿的主要成分是CuFeS2,是工业炼铜的主要原料。已知黄铜矿在空气中焙烧生成Cu、FeS和SO2,FeS+2HCl=FeCl2+H2S↑,H2S是一种剧毒气体。某科研小组设计以黄铜矿为原料制取单质铜和氯化铁晶体(FeCl3·6H2O)的流程如下:
?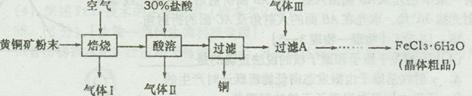
(1)92gCuFeS2在空气中焙烧生成Cu、FeS和SO2转移电子的物质的量为?。
(2)请简述检验气体Ⅰ的操作步骤?。
(3)在实验室中,欲用38%(密度为1.18g·mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有?。
(4)气体Ⅲ最好选用?(填写序号),其主要作用是?。
A.O2
B.H2
C.Cl2
D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体。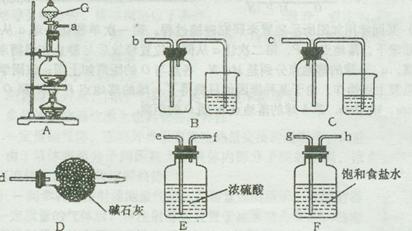
装置A中发生反应的离子方程式为?。
选用合适装置导管口的连接顺序为a接?。图中仪器G的名称是?;在使用该仪器时,应首先?。
参考答案:(14分)(1)3mol
(2)收集适量气体Ⅰ通入品红溶液中,溶液褪色,加热溶液恢复红色
(3)玻璃棒、烧杯、量筒
(4)C?把Fe2+氧化成Fe3+?MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O? ghefb?分液漏斗?检验其是否漏水
MnCl2+Cl2↑+2H2O? ghefb?分液漏斗?检验其是否漏水
本题解析:(1)n(CuFeS2)=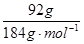 =0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2
=0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2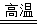 Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
(2)根据题给信息,黄铜矿焙烧生成的气体Ⅰ是SO2,检验SO2的方法是将气体通入品红溶液中,溶液褪色,加热溶液恢复红色。
(3)用溶液配制一定质量分数的溶液,要用到的玻璃仪器有量筒、烧杯和玻璃棒。
(4)气体Ⅲ的作用是将FeCl2氧化成FeCl3,故最好选用Cl2;实验室中用MnO2和浓盐酸在加热条件下制取Cl2,反应的离子方程式为MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
本题难度:一般
2、实验题 (19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。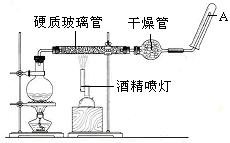
(1)写出该反应的化学方程式?,其中氧化剂是?,还原剂是?。8.4g铁粉参加反应,转移电子?mol。
(2)玻璃管中石棉绒的作用是?,实验开始时应先点燃?,实验结束时应先熄灭?。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶里应事先放置?,其作用是?。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是?,若溶液未变红色则说明硬质试管中固体物质的
成分是?。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是?
?(用离子方程式表示)。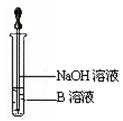
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式??,
?。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有?性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是?,
并且配制含Fe2+的盐溶液时应加入少量?。
参考答案:(1)3Fe+4H2O(g) 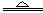 Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
H2O? Fe? 0.4
(2)铁粉的载体,增大铁粉与水蒸气的接触面积?酒精灯?酒精喷灯
(3)为实验提供水蒸气?碎瓷片?防止暴沸
(4)一定有Fe3O4,可能有Fe(各1分)? Fe3O4和Fe
(5)Fe + 2Fe3+= 3Fe2+?
(6)FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4(1分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(1分)
(7)还原?Fe2+易被空气中的氧气氧化而变质?铁粉
本题解析:略
本题难度:一般
3、简答题 甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物.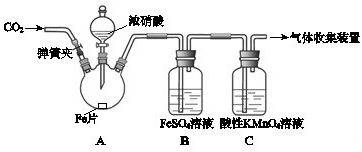
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. 无明显现象. 加热烧瓶,反应开始后停止加热. ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;?B中溶液变棕色;?C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
参考答案:(1)常温时,铁和浓硝酸反应生成一层致密的氧化物薄膜,阻止了铁和浓硝酸进一步反应,即产生钝化现象,所以滴入浓硝酸加热前没有明显现象,
故答案为:常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;
(2)生成-3价氮的化合物是氨气,氨气极易溶于水生成氨水,氨水电离生成铵根离子,检验铵根离子的方法是:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+,故答案为:取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+;
(3)取少量B中溶液,加热,棕色溶于变浅,有无色气体逸出,且该气体在空气中变为红棕色,应为可逆反应FeSO4+NO?Fe(NO)SO4(棕色)是放热反应,升高温度,平衡向逆反应方向移动,导致Fe(NO)SO4(棕色)降低,所以溶液颜色变浅,故答案为:棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色;FeSO4+NO?Fe(NO)SO4(棕色)△H<0?正反应放热,加热后,平衡向逆反应方向移动;
(4)二氧化氮和水反应生成的一氧化氮能使硫酸亚铁溶液变成棕色,所以不能证明铁和浓硝酸反应过程中NO生成,为排除生成的NO干扰,把浓硝酸换成稀硝酸,稀硝酸和铜反应生成无色的一氧化氮,没有二氧化氮生成,则A中气体是无色的,且B中溶液变为棕色,则说明生成的一氧化氮和硫酸亚铁反应生成棕色,从而说明A中无色气体是一氧化氮,
故答案为:浓硝酸换成稀硝酸;A中没有红棕色气体生成,B中溶液变为棕色;
(5)亚铁离子的特征反应是:亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,铁离子的特征反应是:铁离子和无色的硫氰化钾溶液反应血红色溶液,故选cd.
本题解析:
本题难度:一般
4、选择题 高炉炼铁中石灰石的作用
A.除S、P 等杂质
B.催化剂
C.除二氧化硅
D.脱氧
参考答案:C
本题解析:高炉炼铁中石灰石的作用是除二氧化硅,答案选C
本题难度:简单
5、实验题 现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有_____________________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂______________和____________。
(3)实验2通入足量Cl2的目的是________________________________;涉及的化学反应的离子方程式是______________________________。
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是_________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)。________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是________________。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)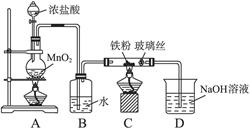
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。
参考答案:(1)烧杯、玻璃棒
(2)稀盐酸铁粉
(3)将Fe2+全部转化为Fe3+ 2Fe2++Cl2====2Fe3++2Cl-
(4)向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净
(5)FeCl3在水中存在如下平衡 FeCl3+3H2O Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体
Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体
(6)CE
(7)2∶3
(8)在B、C之间和C、D之间分别增加盛有浓硫酸的洗气瓶防止FeCl3潮解
本题解析:(2)为了防止FeCl2溶液水解、氧化应加入稀盐酸、铁粉;(4)做此种类型的题时,首先要明确沉淀以上所含杂质,此题中的杂质是Na+、Cl-,检验沉淀是否洗涤干净,只要检验洗涤后的溶液中是否含有Na+、Cl-中的一种就可以。(5)因为FeCl3易水解,且HCl易挥发,加热促进了FeCl3水解及HCl的挥发,所以不能得到FeCl3固体。(6)悬浮在水中的花粉小颗粒也能做布朗运动。向胶体中加入少量的酸、碱、盐,会中和胶体所带的电荷,使胶体发生聚沉,所以向Fe(OH)3胶体中滴加硫酸,会先出现红褐色Fe(OH)3沉淀,但过量的硫酸还会和Fe(OH)3沉淀发生反应生成硫酸铁。CuSO4属于重金属盐,使蛋白质变性。(7)是有关混合物的计算,设FeCl3为x mol,FeCl2为y mol,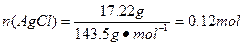
,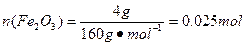 ,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。
,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。
本题难度:一般