时间:2017-07-10 18:26:43
1、实验题 人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般?物质有还原性,??物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因? ③用离子方程式表示溶液变血红色的原因? |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是?(用化学方程式表示) ⑤为什么要用煮沸的水? |
| 4.实施实验 | …… |
| …… | …… |
参考答案:
(1)①低价(态)?高价(态) (1+1=2分)
②2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(2分)
③Fe3+ +3SCN- = Fe(SCN)3(2分)
④2FeCl3+ Fe = 3FeCl2(2分)
⑤除去水中的O2,防止生成的Fe2+被氧化(2分)
(2)⑥原因:SCN-具有还原性,氯水可能部分氧化SCN-;(2分)
⑦改进:取适量FeCl3溶液,加入足量铁粉,然后将所得溶液分装于a、b两支试管,向a试管中直接滴加KSCN溶液,没有明显现象;向b试管中先滴加几滴新制的氯水,后滴加KSCN溶液,溶液立即变红色。(只要合理即可以给分)(2分)
本题解析:实验探究题(1)①根据所给出的离子,从化合价的角度分析氧化还原性,低价物质具有还原性,高价物质具有氧化性;②加入双氧水具有氧化性把Fe2+氧化成Fe3+④铁粉用来还原Fe3+转化为Fe2+;⑤除去溶液中溶解的气体一般采用加热的方法,因为温度高气体溶解度降低;(2)溶液颜色没有出现红色,原因可能是Fe3+ 和SCN-缺少一种,溶液中氯水能氧化出Fe3+ ?,所以结果只有一种可能就是SCN-被氧化。为了避免SCN-氧化,应先加入氯水后,在加入KSCN溶液,具体操作应为取适量FeCl3溶液,加入足量铁粉,然后将所得溶液分装于a、b两支试管,向a试管中直接滴加KSCN溶液,没有明显现象;向b试管中先滴加几滴新制的氯水,后滴加KSCN溶液,溶液立即变红色。
本题难度:一般
2、选择题 把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是(?)
A.H+?B. Cu2+?C.Fe3+? D. Fe2+
参考答案:D
本题解析:
正确答案:D
Fe+2Fe3+=3Fe2+? Fe+Cu2+=Fe2++Cu ,所以溶液中最多的阳离子是Fe2+ .
本题难度:简单
3、填空题 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: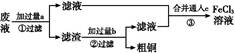
写出一个能证明还原性Fe比Cu强的离子方程式:?。
该反应在上图步骤?中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
| ? |
参考答案:Fe+Cu2+=Fe2++Cu ①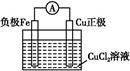
粗铜,Cu-2e-=Cu2+
本题解析:根据题干信息可知废液应为FeCl3、CuCl2、FeCl2的混合溶液,加入的试剂a为Fe,发生反应为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,经①过滤后,滤渣是Fe与Cu的混合物,再加入过量的b(盐酸)发生反应:Fe+2HCl=FeCl2+H2↑,经②过滤后滤液主要是FeCl2溶液,将合并后的溶液中通入c(Cl2),发生主要反应为:2Fe2++Cl2=2Fe3++2Cl-。Fe+Cu2+=Fe2++Cu可以证明Fe比Cu还原性强,该反应在步骤①中发生。将Fe+Cu2+=Fe2++Cu设计成原电池,Fe作负极,比Fe不活泼的Cu作正极即可,电解质溶液是含Cu2+的溶液。电解精炼铜时,粗铜作阳极,精铜作阴极。
本题难度:一般
4、填空题 (14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+ 、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。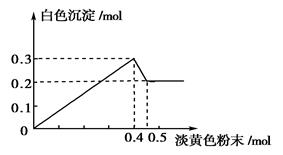
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
参考答案:(1)过氧化钠
(2)NH4 +、Mg2+、Al3+ Cu2+、Fe3+
+、Mg2+、Al3+ Cu2+、Fe3+
(3)c(NH4+)∶c(Mg2+)∶c(Al3+)=1∶2∶1
(4)①2Na2O2+2H2O===4NaOH+O2↑
②NH4++OH-NH3↑+H2O
③Al(OH)3+OH-===[Al(OH)4]
本题解析:略
本题难度:一般
5、选择题 m g FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将m g的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,得固体w g。则w的值为
A.m-0.96
B.m-1.44
C.m-1.6
D.m-2.4
参考答案:B
本题解析:向所得溶液中加入NaOH溶液,是为了中和体系中的硫酸,故体系中硫酸为0.03mol。所以生成金属硫酸盐的硫酸根离子为0.12-0.03=0.09mol。因原氧化物中氧原子数目与金属硫酸盐中硫酸根离子数目相等,故混合物中的氧原子也为0.09mol,质量为0.09*16=1.44克,所以混合物中金属的质量w=m-1.44。
故选B
本题难度:简单