时间:2017-07-10 18:26:43
1、选择题 在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,问神秘的X不可能是(?)
A.FeCl3
B.HNO3
C.HCl
D.KNO3
参考答案:C
本题解析:由于Cu的活动性在H之后,所以Cu与稀硫酸不发生反应。再加入某X物质,发现铜粉逐渐溶解。说明加入的物质电离产生的微粒能与硫酸的成分结合形成氧化性强的物质。或直接能与Cu发生反应。A.Cu+ 2FeCl3= 2FeCl2+CuCl2.错误。B.3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O?。错误。C.HCl、H2SO4都不能与Cu发生反应,相互之间也不反应。符合题意。正确。D.KNO3与H2SO4的混合溶液起硝酸的作用,能把Cu氧化为Cu(NO3)2。错误。
本题难度:一般
2、选择题 合金是一类用途广泛的金属材料,下列物质中属于合金的是(? )?
A.钢
B.水银
C.金刚石
D.四氧化三铁
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列说法正确的是( )
A.Fe与过量稀H2SO4反应可以生成Fe2(SO4)3
B.Cu与FeCl3溶液反应可以说明Cu比Fe活泼
C.FeCl2不能通过化合反应得到
D.证明FeCl2溶液中含有FeCl3可以用KSCN溶液证明
参考答案:D
本题解析:Fe与过量稀H2SO4反应只能生成硫酸亚铁,A不正确;B不正确,该反应不能说明,且铁的金属性就是比铜强;C不正确,例如铁和氯化铁反应生成氯化亚铁,因此答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,主要是考查学生对铁及其化合物性质和铁离子检验的熟悉掌握程度,有利于培养学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的应试能力和学习效率。
本题难度:简单
4、实验题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究: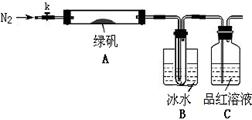
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):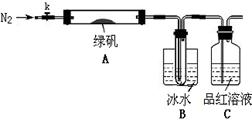
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?;
结论2:C中溶液褪色,可推知产物中有?;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:?。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?。
a.氯水和KSCN溶液? b.酸性KMnO4溶液? c.H2O2? d.NaOH溶液
参考答案:(1)除油污;
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在;
(3)用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗;
(4)H2SO4溶液、SO2;
(5)在C装置后增加一套尾气处理装置;?
(6)b。
本题解析:(1)碳酸钠溶液与废铁屑的成分均不能反应,故只起去油污的作用;(2)结合废铁屑的成分和后边的步骤可知,必须保证铁有剩余,才能保证溶液中没有铁离子;(3)降低温度,减小绿矾的溶解度;(4)硫酸亚铁晶体受热有水蒸汽生成,根据三氧化硫的熔点可知,冰水能将三氧化硫和水液化,在B中反应生成硫酸;C中是生成的二氧化硫使品红溶液褪色;(5)二氧化硫要进行尾气处理;(6)固体中有氧化铁,溶于盐酸后有三价铁生成,要想检验二价铁的存在,需利用亚铁离子的还原性,使酸性高锰酸钾溶液褪色,故选b。
本题难度:困难
5、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程: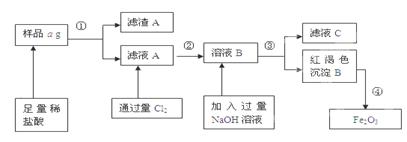
(1)滤液C中溶质含有_? _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____?_____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___?__。
参考答案:(1)NaAlO2、NaCl、NaOH (2)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。 (3)(7b/10a)×100%
本题解析:(1)样品中加入足量的稀盐酸发生的反应为Fe + 2HCl=FeCl2 + H2↑;2Al+6HCl=2AlCl3+3H2↑滤液中含有FeCl2和AlCl3,滤渣中含有Cu等难溶性杂质。向滤液中通入过量的氯气发生反应2FeCl2+Cl2="=" 2FeCl3,再向溶液中加入过量的NaOH溶液时发生反应AlCl3+4NaOH=3NaCl+NaAlO2+2H2O. FeCl3+3NaOH =3NaCl+Fe(OH)3↓.过滤得到的滤液C中含有NaCl、NaAlO2、NaOH。红褐色沉淀为Fe(OH)3。将其灼烧分解得到Fe2O3和水。(2)验证滤液A中含Fe2+,而不含Fe3+的方法是取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。或加入氢氧化钠溶液首先产生白色沉淀。白色沉淀迅速变为灰绿色,最后变为红褐色。(3)n(Fe2O3)=bg÷160g/mol.n(Fe)=2×n(Fe2O3)=b/80mol.所以该样品中铁元素质量分数为(b/80mol×56g/mol)÷ag×100%="(7b/10a)×100%" .?3+的检验等知识。
本题难度:一般