时间:2017-07-10 18:26:21
1、实验题 (一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体?。
(2)配制氯化钠溶液时,容量瓶中有少量水。?。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。?。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为?。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | ? 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
参考答案:(一)(3分,各1分)(1)偏低?(2)无影响?(3)偏低
(二)(1)烧杯、玻璃棒、250mL容量瓶、胶头滴管(2分)
(2)1?(1′)? A、B、G?(共2′)
(3)0.425 mol/L(共2′)
本题解析:考查溶液的配制、中和滴定等实验操作
(一)(1)称取已吸潮的氢氧化钠固体,将使溶质的质量偏小,最终溶液浓度偏低
(2)容量瓶内有少量水对溶液浓度没有影响
(3)溶液液面超过刻度线,也就是在定容时加水过多,将使浓度偏低(只能重新配制溶液)
(二)(1)见答案
(2)比较三组数据可知,第一组所消耗标准溶液体积与其它组相关较大,即误差较大的数据
A、滴定管没有用标准液润洗,将使标准液浓度偏小,导致所消耗标准液体积偏大,正确
B、气泡的体积充当了标准液的体积,导致所消耗标准液体积偏大,正确
C、将导致标准液体积偏小,排除
D:不影响结果,排除
E:将导致标准液体积偏小,排除
F、导致标准液损耗,偏小,排除
G、说明滴加标准液偏多,正确
(3)根据多次测量求证平均值的原则可知标准液的体积为17.00ml,则由c(HCl)×0.020=0.5×0.017可计算出:盐酸溶液的物质的量浓度为0.425 mol/L
本题难度:简单
2、选择题 下列实验方法正确的是
A.配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可
B.区别Na2CO3和NaHCO3时,可将它们分别和Ca(OH)2溶液混合,看有无沉淀产生
C.区别FeCl3溶液和Fe(OH)3胶体时,可将它们分别用一束光照射,看有无丁达尔效应出现
D.检验某溶液中是否含有NH4+离子时,可加入适量的氢氧化钠溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体即可
参考答案:C
本题解析:A多余液体不能吸出,错误;BNa2CO3和NaHCO3时Ca(OH)2溶液混合都有沉淀产生,不能区别,错误;C正确。D.应用湿润的红色石蕊试纸变蓝来检验产生的氨气,错误;
本题难度:一般
3、选择题 控制变量法在化学实验探究中运用较多,它是指在研究和解决问题的过程中,对影响事物变化规律的因素或条件加以人为控制,使其中的一些条件按照特定的要求发生或不发生变化,以便在研究过程中,找到事物变化发展的规律。根据因素和条件的性质,可分为实验变量(自变量)、反应变量(因变量)和无关变量。某研究小组用酸性KMnO4溶液与H2C2O4溶液反应中溶液紫色消失的方法,来研究浓度对化学反应速率的影响。下列实验有关变量控制的操作错误的是? (? )
A.为控制无关变量的影响,将实验温度均确定为25°C、酸性KMnO4溶液与H2C2O4溶液的体积均确定为4mL,不使用催化剂
B.可选择浓度分别为0. 05mol/L、0. 01mol/L、0. OO1mol/L的KMnO4酸性溶液和浓度均为0. OO1mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验
05mol/L、0. 01mol/L、0. OO1mol/L的KMnO4酸性溶液和浓度均为0. OO1mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验
C.可将单位时间内反应所生成的CO2体积作为实验变量(自变量)进行本实验研究
D.该实验研究中的反应变量(因变量)是溶液紫色褪去所消耗的时间
参考答案:C
本题解析:略
本题难度:一般
4、选择题 粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作。下列图示对应的操作不规范的是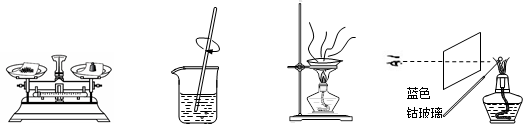
A.称量
B.溶解
C.蒸发
D.焰色反应
参考答案:C
本题解析:A、称量时左物右码,且应托盘需放置称量纸,正确;B、溶解需用玻璃棒搅拌加快溶解,正确;C、蒸发需用玻璃棒搅拌,使受热均匀,错误;D、做钾元素的焰色反应需用蓝色钴玻璃滤去钠的黄色,正确。
本题难度:一般
5、选择题 (16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:




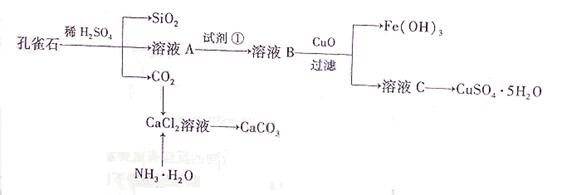

 请回答下列问题:
请回答下列问题: (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。 a.KMnO4 b.(NH4) 2S? c.H2O2? d.KSCN
a.KMnO4 b.(NH4) 2S? c.H2O2? d.KSCN (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
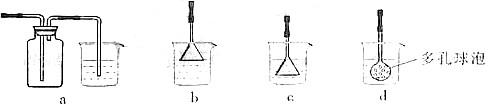
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。


 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
参考答案: (1)c;d
(1)c;d
(2)冷却结晶;引流
(3)NH3(或NH3·H2O);b d
(4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平;酸式
本题解析: (1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+?选择SCN-(2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
(1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+?选择SCN-(2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
本题难度:一般