时间:2017-07-10 18:16:44
1、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。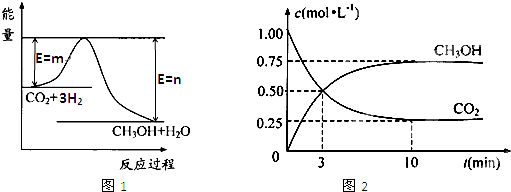
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使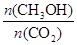 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
参考答案:(1)CO2(g)+3H2(g)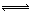 CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
(2)C(1分) (3)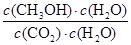 (1分)
(1分)
(4)增大(1分) (5)0.225mol/(L·min)(1分) (6)C(1分)
本题解析:(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应。反应热等于反应物的总能量和生成物总能量的差值,因此该反应的热化学方程式为CO2(g)+3H2(g)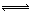 CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
(2)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0;由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0,所以答案选C。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据可逆反应可逆反应CO2(g)+3H2(g)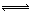 CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K=
CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K=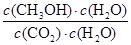 。
。
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大。
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=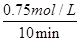 =0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
=0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
(6)使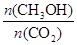 增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,
增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,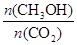 减小,故A错误;B、加入催化剂,平衡不移动,
减小,故A错误;B、加入催化剂,平衡不移动,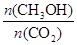 不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,
不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,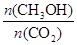 增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,
增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,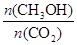 不变,故D错误;答案选C。
不变,故D错误;答案选C。
考点:考查热化学方程式的书写、外界条件对平衡状态和平衡常数的影响、反应速率的计算等
本题难度:困难
2、选择题 表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
参考答案:B
本题解析:A不正确,因为晶格能是在反应时1mol离子化合物中的阴阳离子从相互分离的气态结合成离子晶体时所放出的能量,因此生成物氯化钠应为气态;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能计算可知,B正确;氯化钠是离子化合物,其熔点比晶体硅低,C错误;微粒半径越大共价键越弱,D错误。
本题难度:一般
3、选择题 已知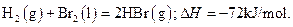 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
A.404
B.260
C.230
D.200
参考答案:D
本题解析:略
本题难度:简单
4、选择题 常温下,下列各组离子在指定溶液中可能大量共存的是
A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、I-
B.由水电离的c(H+)=1.0×10-13mol?L-1的溶液中:K+、NH4+、AlO-、CO32-
C.=1012的溶液中:NH4+、Al3+、NO3-、CO32-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
参考答案:D
本题解析:分析:A、碘离子具有还原性,铁离子具有氧化性;
B、由水电离的c(H+)=1.0×10-13mol?L-1的溶液显示酸性或是碱性;
C、根据离子之间的关系结合水的离子积可以计算溶液中氢离子和氢氧根离子的浓度,进而确定酸碱性;
D、与铝反应产生大量氢气的溶液可以是酸性或是碱性溶液.
解答:A、碘离子具有还原性,Fe3+、NO3-具有氧化性,会发生氧化还原反应不能共存,故A错误;
B、由水电离的c(H+)=1.0×10-13mol?L-1的溶液显示酸性或是碱性,在酸性环境下,碳酸根、偏铝酸根离子不能共存,在碱性环境下,铵根离子不能共存,故B错误;
C、根据离子之间的关系结合水的离子积可以计算溶液中氢离子的浓度为10-13mol/L,溶液显示碱性,铵根离子和铝离子均不能共存,故C错误;
D、与铝反应产生大量氢气的溶液可以是酸性或是碱性溶液,碱性环境下,Na+、K+、CO32-、NO3-能共存,故D正确.
故选D.
点评:本题考查离子共存问题,题目难度中等,注意教材知识的梳理和归纳是解题的关键.
本题难度:一般
5、选择题 下列叙述正确的是
A.熵变小于零而焓变大于零的反应肯定不能发生
B.热化学方程式中ΔH的值与反 应物的用量有关
C.化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变
D.用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小
参考答案:C
本题解析:A、熵变小于零即△S<0,焓变大于零即△H>0,△G=△H-T△S>0,反应不自发进行,不代表反应不能发生,错误;B、热化学方程式中ΔH的值与反应物的用量无关,与热化学方程式中反应物的系数有关,错误;C、化学反应中旧键断裂吸收能量,新键形成释放能量,但遵循能量守恒定律,反应前后物质的总能量不变,所以化学反应伴随能量变化,正确;D、醋酸的稀释过程中,氢离子、醋酸根离子的浓度减小,但氢氧根离子的浓度增大,错误,答案选C。
考点:考查反应自发的判断,热化学方程式与热效应的关系,溶液稀释过程离子浓度的变化
本题难度:一般