时间:2017-07-10 18:16:44
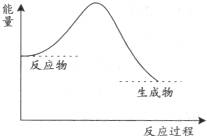
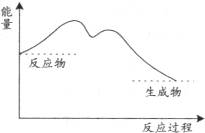
1、选择题 下列图中,表示正反应为放热反应的是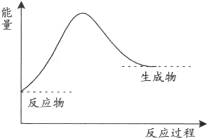
A. B. 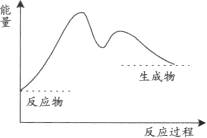
C. D.
参考答案:BD
本题解析:根据反应物的总能量高于生成物的总能量属于放热反应,反应物的总能量低于生成物的总能量属于吸热反应。联合图像可推知AC两图属于吸热反应,BD两图属于放热反应。故选BD。
考点:吸热反应和放热反应的概念及图像表示法。
点评:了解吸热反应和放热反应的概念及图像表示法,熟知反应物的总能量高于生成物的总能量属于放热反应,反应物的总能量低于生成物的总能量属于吸热反应。可以轻松找到答案。
本题难度:简单
2、选择题 下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是(?)
①H2O? ②NH3? ③F—? ④CN—? ⑤CO
A.①②
B.①②③
C.①②④
D.①②③④⑤
参考答案:D
本题解析:①H2O,O上有2对孤对电子,[Cu(H2O)4]2+;
②NH3,N上有1对孤对电子,[Cu(NH3)4]2+;
③F-,F上有4对孤对电子 [FeF6]3-;
④CN-,C上有1对孤对电子 [Fe(CN)6]3-;
⑤CO,C、O上都有1对孤对电子 CO中毒后,CO与血红蛋白中的Fe2+配位。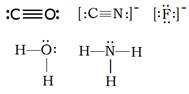
故选D。
点评:本题考查的是配位键的相关知识,题目难度不大,注意基础知识的学习、掌握及应用。
本题难度:一般
3、填空题 2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
⑴Ea的大小对该反应的△H _______(填“有”或“无”)影响。
⑵已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:___________ ________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。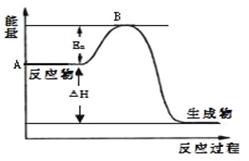
参考答案: ⑴无 ⑵S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1 1185kJ
本题解析:(1)Ea表示反应的活化能,活化能的大小与反应热大小无关系。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1。
(3)根据盖斯定律可知,S(s)+3/2 O2(g)="=" SO3(g)△H =-395kJ·mol-1。 所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
本题难度:一般
4、选择题 下列有关能量的描述及热化学反应方程式表示不正确的是
A.表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1
B.化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热可以用量热计直接测量
C.已知C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;
CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1
则C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1
D.关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”。
参考答案:B
本题解析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1,A正确;B、化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热并能用量热计直接测量,B错误;C、已知① C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;②CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1,则根据盖斯定律可知①-②得到C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1,C正确;D、关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”,D正确,答案选B。
考点:考查反应热的有关判断、盖斯定律的应用等
本题难度:一般
5、选择题 下列现象与氢键有关的是:
①水结成冰体积膨胀,密度变小
②水加热到很高温度都难以分解
③HF、HCl、HBr、HI的热稳定性依次减弱
④对羟基苯甲醛的沸点高于邻羟基苯甲醛
⑤Cl2、Br2、I2单质熔点随相对分子质量增大而升高
⑥NH3极易溶于水中
A.①④⑥
B.①②③④⑤
C.①④
D.①②③
参考答案:A
本题解析:①水结成冰时分子排列为有序,使体积膨胀,密度变小,与氢键有关。正确。②水加热到很高温度都难以分解,说明水分子内的化学键结合力强,难断裂,与氢键强弱无关。错误。③HF、HCl、HBr、HI的热稳定性依次减弱与分子内的化学键强弱有关,而与物质的分子间作用力无关,也与氢键无关。错误。④对羟基苯甲醛的沸点高于邻羟基苯甲醛是由于在对羟基苯甲醛的分子之间存在氢键,增加了分子之间的相互吸引力。正确。⑤Cl2、Br2、I2单质都是由分子构成的物质。结构相似。分子的相对分子质量越大,分子之间的作用力就越大,克服分子之间的作用力使物质熔化或汽化消耗的能量就越高,即熔点随相对分子质量增大而升高。但是与氢键无关。错误。⑥NH3极易溶于水中,由于在氨分子与水分子之间容易形成氢键。正确。与氢键有关现象的是①④⑥。选项为A。
本题难度:一般