时间:2017-07-10 18:07:31
1、选择题 已知:
2CO(g)+O2(g)=2CO2(g)?ΔH=-566?kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)? ΔH=-226?kJ/mol
根据以上热化学方程式判断,下列说法正确的是 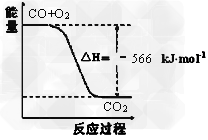
[? ]
A、CO的燃烧热为283?kJ
B、上图可表示由CO生成CO2的反应过程和能量关系
C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)?ΔH>-452?kJ/mol
D、CO(g)与Na2O2(s)反应放出509?kJ热量时,电子转移数为1.204×1024
参考答案:CD
本题解析:
本题难度:一般
2、填空题 (10分)25 ℃时,硫氢化钾溶液里存在下列平衡:
(a)HS-+H2O?
 ?OH-+H2S
?OH-+H2S
(b)HS-?
 ?H++S2-
?H++S2-
(1)________是电离平衡;________是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向________移动;水解平衡向________移动;c(H+)变________(填“大”或“小”)。
(3)当向其中加入氢氧化钠固体时,c(S2-)变________(填“大”或“小”)。
(4)若将溶液加热至沸腾,c(OH-)·c(H+)将变________(填“大”或“小”)。
参考答案:(1)b a (2)正反应方向 逆反应方向 大? (3)大 (4)大
本题解析:
(1) (a)HS-+H2O?
 ?OH-+H2S是水解方程式; (b)HS-?
?OH-+H2S是水解方程式; (b)HS-?
 ?H++S2-是电离方程式;⑵加入Cu2+后,S2―离子浓度减小,电离平衡正反应方向,水解平衡向逆反应方向移动,c(H+)变大,⑶加入氢氧化钠固体,c(H+)变小,电离平衡正向移动,c(S2-)变大;⑷水电离吸热,升高温度,水离子积变大。
?H++S2-是电离方程式;⑵加入Cu2+后,S2―离子浓度减小,电离平衡正反应方向,水解平衡向逆反应方向移动,c(H+)变大,⑶加入氢氧化钠固体,c(H+)变小,电离平衡正向移动,c(S2-)变大;⑷水电离吸热,升高温度,水离子积变大。
本题综合考查电离平衡和水解平衡。抓住题目给出的平衡的移动方向,合理判断离子浓度变化。
本题难度:一般
3、选择题 水的电离平衡曲线如下图所示。下列说法正确的是? ( )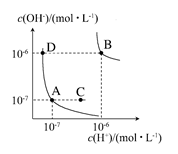
A.图中对应点的温度关系为A>B
B.水的电离常数KW数值大小关系为B>D
C.温度不变,加入少量NaOH可使溶液从C点变到A点
D.在B点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
参考答案:B
本题解析:温度越高KW越大,故A错误;B点及其所在曲线上的点表示的KW为1×10-12,而A点及其所在曲线上的点表示的KW为1×10-14,故B正确;温度不变,KW不变,加入少量NaOH也不能使溶液从C点变到A点,只有改变温度方可实现,C错误。
本题难度:一般
4、选择题 pH和体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同的条件下收集到的二氧化碳的体积(? )
A.醋酸多
B.硫酸多
C.一样多
D.无法比较
参考答案:A
本题解析:在pH和体积都相同的醋酸和硫酸中,电离的H+的物质的量相等。H2SO4是强酸,已完全电离成H+、SO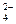 。CH3COOH是弱酸,部分电离,溶液中存在大量未电离的CH3COOH分子。在与Na2CO3反应的过程中,未电离的CH3COOH分子可以不断电离出H+参与反应,导致产生的CO2较多。
。CH3COOH是弱酸,部分电离,溶液中存在大量未电离的CH3COOH分子。在与Na2CO3反应的过程中,未电离的CH3COOH分子可以不断电离出H+参与反应,导致产生的CO2较多。
本题难度:一般
5、选择题 下列说法正确的是?
A.某水溶液中只要c(H+)=c(OH-),则一定是中性的
B.纯水中c(H+)与c(OH-)的乘积一定等于1×10-14
C.温度升高水的电离程度增大,pH值增大
D.电离程度大的酸一定比电离程度小的酸pH值小
参考答案:A
本题解析:某水溶液中只要c(H+)=c(OH-),则一定是中性的,故A正确;只有在常温下,纯水中c(H+)与c(OH-)的乘积才等于1×10-14,故B错误;温度升高水的电离程度增大,pH值减小,故C错误;电离程度大的酸一定比电离程度小的酸pH值小,这种说法是错误的,因为没有指定浓度。
点评:本题考查了化学术语,属于对基础知识的考查,本题比较溶液,注意的是水中c(H+)与c(OH-)的乘积才等于1×10-14。
本题难度:一般