时间:2017-07-10 18:06:25
1、选择题 在标准状况下,下列物质中含分子数最少的是
A.10LN2
B.16gO2
C.2gH2
D.1LH2O
2、选择题 某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定只有SO2和NO
B.肯定没有Cl2、O2和NO
C.可能有Cl2和O2
D.肯定只有NO
3、选择题 某化合物的结构式(键线式)及球棍模型如下: 
该有机分子的核磁共振氢谱图如下(单位ppm)。 
下列关于该有机物的叙述正确的是
[? ]
A.该有机物不同化学环境的氢原子有4种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3
D.该有机物在一定条件下能够发生取代反应
4、选择题 2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量(10-9g)的化合物通过质谱仪的离子化室,使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度表示碎片质量,与该离子的多少有关),则该有机物可能是 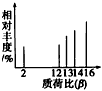
[? ]
A.甲醇
B.甲烷
C.丙烷
D.乙烯
5、选择题 某有机化合物的相对分子质量是60,由碳、氢、氧三种元素组成,其红外光谱图有C-H键、 O-H键、C-O键的振动吸收,核磁共振氢谱显示该分子中有四种不同化学环境的H,则该有机物的结构简式是
[? ]
A.CH3CH2OCH3
B.CH3CH(OH)CH3
C.CH3CH2CH2OH
D.CH3CH2CHO