时间:2017-03-05 16:09:09
1、选择题 下图所示的装置中,观察到电流计指针偏转,同时M棒变粗,N棒变细,由此判断下表中所列M,N,P物质,其中可以成立的是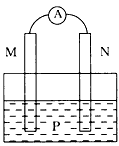
[? ]
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列关于化学能与电能相互转化的说法正确的是( )
A.在原电池中,化学能转变为电能,电子沿导线由正极流向负极
B.双液原电池中两个隔离的半电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移
C.在电解池中,与电源负极相连的电极称为阴极,该极发生氧化反应
D.电解氯化铜溶液,在阴极上产生的气体能使湿润的KI-淀粉试纸变蓝
参考答案:A.原电池为化学能转化为电能的装置,电子由负极流向正极,故A错误;
B.原电池中阳离子向正极移动,则双液原电池中两个隔离的半电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移,故B正确;
C.在电解池中,与电源负极相连的电极称为阴极,电解池的阴极发生还原反应,故C错误;
D.电解氯化铜溶液,阳极上生成氯气,则在阳极上产生的气体能使湿润的KI-淀粉试纸变蓝,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 ?依据氧化还原反应: 2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题: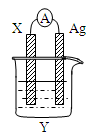
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为_______? ___;X电极上发生的电极反应为_____________________;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。
(4)当有1.6g铜溶解时,银棒增重_________________。
参考答案:(1)Cu;AgNO3
(2)正极;?Ag++e-=Ag;?氧化反应
(3)X(或Cu);Ag
(4)5.4g
本题解析:在原电池的总反应方程式中,化合价升高的做负极,所以在这个原电池中,铜做负极,而负极的活泼性大于正极,因此,正极我们可以选择银或者碳棒。总反应式中有银离子参与反应,所以在电解质溶液中会含有银离子。因此电解质溶液,我们可以选择硝酸银。正极发生的是氧化反应,电极反应式为?Ag++e-=Ag。电子的流动方向是负极指向正极,所以应是铜流向银。1.6克的铜相当于0.025摩尔的铜。即失去0.025乘以2等于0.05摩尔的电子。而据得失电子总数相等可知,银离子应得到0.05摩尔的电子由?Ag++e-=Ag可知会得到0.05摩尔的银则银的质量为0.05乘以108等于5.4克。
本题难度:一般
5、选择题 试判断下列哪个装置中灯泡会亮 ?
?
参考答案:C
本题解析:A项:没有形成闭合回路,灯泡不会亮,故错;B、D项:没有氧化还原反应发生,即没有电荷移动,灯泡不会亮,故错。故选C。
点评:记住原电池的形成条件是解题的关键,两个电极、电解质溶液、发生氧化还原反应形成闭合回路。
本题难度:简单