时间:2017-03-05 16:08:30
1、选择题 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
[? ]
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
参考答案:A
本题解析:
本题难度:一般
2、选择题 某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾.该化学品可能是
A.NaCl
B.KMnO4
C.CH3COOH
D.CuSO4
参考答案:B
本题解析:本题考查酒精的化学性质,属容易题.只要了解酒精及题中四选项物质的性质就很容易找出答案,酒精是易燃物,有还原性,遇强氧化剂易被氧化发热,达到着火点就会引起火灾.题中四个选项中只有KMnO4有强氧化性,故B正确.
本题难度:一般
3、选择题 在下列反应中,盐酸作氧化剂的是
A.Zn+2HCl=H2↑+ZnCl2
B.CaCO3+2HCl=CO2↑+CaCl2+H2O
C.HCl+NaOH=NaCl+H2O
D.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
参考答案:A
本题解析:分析:从元素的化合价的角度分析,盐酸作氧化剂,H元素的化合价应降低生成氢气.
解答:A.H元素的化合价降低,HCl被还原,为氧化剂,故A正确;
B.各元素的化合价都没有变化,盐酸表现出酸性,故B错误;
C.各元素的化合价都没有变化,盐酸表现出酸性,故C错误;
D.反应中Cl元素化合价升高,盐酸为还原剂,故D错误.
故选A.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价的角度判断反应是否氧化还原反应并判断物质所起到的作用.
本题难度:一般
4、选择题 0.3mol Cu2S与足量的浓HNO3反应,生成?Cu(NO3)2、H2SO4、NO、H2O,则参加反应的硝酸中,未被还原的硝酸的量是
[? ]
A.75.3g
B.2.2mol
C.1.2mol
D.1mol
参考答案:C
本题解析:
本题难度:一般
5、选择题 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。则该条件下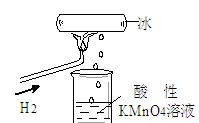
A.生成的水分子化学性质比较活泼
B .H2燃烧生成了具有氧化性的物质
C.H2燃烧的产物中可能含有一定量的H2O2
D.H2被冷却为液态氢,液氢的水溶液具有还原性
参考答案:C
本题解析:从反应现象可看出,生成了一种物质:既具有氧化性又具有还原性:2MnO + 5H2O2+ 6H+= 2Mn2++ 5O2↑+8H2O和H2O2+2H+ +2Fe2+=2Fe3++2H2O,答案为C
+ 5H2O2+ 6H+= 2Mn2++ 5O2↑+8H2O和H2O2+2H+ +2Fe2+=2Fe3++2H2O,答案为C
本题难度:简单