时间:2017-03-05 16:00:49
1、选择题 一些烷烃的燃烧热如下表:
| 化合物 | 燃烧热/kJ?mol-1 | 化合物 | 燃烧热/kJ?mol-1 甲烷 891.0 正丁烷 2?878.0 乙烷 1?560.8 异丁烷 2?869.6 丙烷 2?221.5 2-甲基丁烷 3?531.3 |
参考答案:A、正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正丁烷的燃烧热大于2-甲基丁烷,即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故A错误;
B、由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故B正确;
C、根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,故C错误;
D、相同质量的烷烃,氢的质量分数越大,燃烧放热越多,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为(?)
A.1010:1
B.5×109:1
C.108:1
D.1:1
参考答案:C
本题解析:液的pH=11,则溶液中氢离子的浓度就是10-11mol/L。氢离子全部是水电离出的,所以由水电离出的OH-浓度也是10-11mol/L。因此由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为10-11︰10-3=108:1 答案选C。
本题难度:简单
3、选择题 下列热化学方程式中的△H能表示可燃物的燃烧热的是
[? ]
A.H2(g)+ Cl2(g)=2HCl(g) △H=-184KJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3J·mol-1
C.CO(g)+1/2O2(g)=CO2(g) △H=-293KJ·mol-1
D.2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-1
参考答案:C
本题解析:
本题难度:一般
4、选择题 Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g)?△H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g)?△H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式?。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: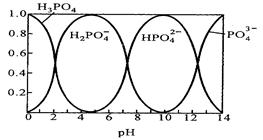
(1)在Na3PO4溶液中,c(Na+)/c(PO43-)??3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为??。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是?。(填选项字母)
A、C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)>? C(OH-)>? C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )?
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )?
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
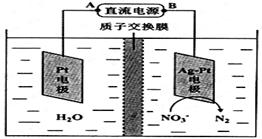
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为?(填A或B),阴极反应式为?。
参考答案:Ⅰ.CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol?(2分)
Ⅱ.(1)>? HPO4 2- +? H+=?H2PO4 -?(每空2分,共4分)
(2)AD(2分)
(3)? PO43-?+? H2O 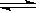 ?HPO4 2- +? OH-?(1分)
?HPO4 2- +? OH-?(1分)
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01? (1分)
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.?A? 2NO3-+10e-+12H+=6H2O +N2↑?(每空2分,共4分)
本题解析:Ⅰ.根据已知方程式和盖斯定律,甲醇燃烧的化学方程式为可由(①—②×4)÷2而得,因此表示甲醇燃烧热的热化学方程式为:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol。
Ⅱ.(1)Na3PO4溶液中,PO43- 发生水解,因此c(Na+)/c(PO43-)>3,从磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线图可以看出,在pH从10降低到5的过程中,主要是HPO4 2- 的含量在逐渐减小为0,而H2PO4 – 的含量在逐渐增大,因此发生的主要反应的离子方程式为HPO4 2- +? H+=?H2PO4 - 。
(2)从图中可以看出,H2PO4 – 离子在酸性条件下才能大量存在,因此说明H2PO4 – 的电离大于水解,因此NaH2PO4溶液中有C(HPO4 2-)> C(H3PO4 ),又水电离出的一部分H+ ,因此离子浓度大小顺序有C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 ),因此A正确;由于H2PO4 – 发生水解和电离后,溶液中含P的微粒有H2PO4-、HPO42- 、PO43-、H3PO4?4种,因此电荷守恒式C错误;物料守恒式D正确。故选AD。
(3)根据溶液水解后的PH=12,可以计算水解产生的c(OH-)=0.01mol/L?,列成三段式有:
PO43-?+? H2O 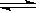 ?HPO4 2- +? OH-?
?HPO4 2- +? OH-?
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01?
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=?0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.从原理示意图中可以看出,该装置是一个电解池装置,要降解的硝酸盐变成了N2,因此在图中的右侧发生了还原反应,该极为阴极,电源的A极则是正极。阴极反应的方程式为:2NO3-+10e-+12H+=6H2O +N2↑。
本题难度:困难
5、选择题 用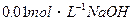 溶液完全中和pH=3的下列溶液各100mL,需
溶液完全中和pH=3的下列溶液各100mL,需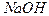 溶液体积最大的是?(?)
溶液体积最大的是?(?)
A.盐酸
B.硫酸
C.高氯酸
D.醋酸
参考答案:D
本题解析:略
本题难度:一般