时间:2017-03-05 15:58:31
1、选择题 我国拥有完全自主产权的氢氧燃料电池车已经在北京奥运会期间为运动员服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
A.工作一段时间后,负极周围的pH增大
B.工作后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应式为:2H2 + O2 = 2H2O
D.用该电池电解CuCl2溶液,产生7.1g Cl2时,电子转移0.1mol
参考答案:AD
本题解析:A.氢氧燃料电池的负极反应为H2-2e-+2OH-=2H2O,OH-不断消耗,工作一段时间后,负极周围的pH减小,错误;B.原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。所以在氢氧燃料电池中,氢气在负极通入,氧气在正极通入。而溶液中氢氧化钾的物质的量是不变的,正确;C. 该燃料电池的总反应式为:2H2 + O2 = 2H2O,正确;D.标准状况下7.1g氯气的物质的量是0.2mol,转移电子的物质的量是0.2mol×2=0.4mol,错误;选AD。
考点:考查电化学的有关判断和计算。
本题难度:一般
2、选择题 有关铜-锌-稀硫酸构成的原电池中的一些说法正确的是
A.锌片为正极,且锌片逐渐溶解
B.铜片为负极,且铜片上有气泡
C.溶液中的H+移向铜极
D.该电池工作的过程中溶液的pH始终不变
参考答案:C
本题解析: 在此原电池中锌是负极,锌逐渐反应而溶解,铜是正极,溶液中的氢离子向铜电极移动,在铜极反应产生气体,电池工作的过程中氢离子浓度减小,故pH增大。故选C。
考点: 原电池的原理
本题难度:一般
3、选择题 如图为原电池示意图,下列说法正确的是( )
A.锌片是正极,铜片是负极
B.硫酸的浓度不变
C.该装置能够将电能转化为化学能
D.电子由锌片通过导线流向铜片
参考答案:A、锌片是负极,铜片是正极,故A错误;
B、溶液中氢离子减少,硫酸浓度减小,故B错误;
C、该装置能够将化学能转化为电能,故C错误;
D、电子由锌片通过导线流向铜片,故D正确;
故选D.
本题解析:
本题难度:一般
4、填空题 (9分) (1)下列反应能设计成化学能转化为电能的装置是
A Zn+CuSO4=ZnSO4+Cu B NaOH+HCl=NaCl+H2O
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式:
正极反应 负极反应 .
(3)某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,请写出该烃同分异构体中有4种不同沸点的一氯代物的该烃的结构简式,并命名:
、
参考答案:(1) A (1分)
(2) Cu2++2e-=Cu (1分)Zn-2e-=Zn2+ (1分)(正极材料只要合理均可)(2分)
(3)C5H12 (1分) (1分) 2-甲基丁烷(或异戊烷)(1分)
本题解析:(1)因为电子的定向移动才能形成电流,所以只有氧化还原反应才能设计成原电池,即选项A正确。
(2)根据反应式可知,锌是还原剂,失去电子,作负极。铜离子得到电子,在正极得到电子析出。电极反应式分别为负极反应: Zn-2e-=Zn2+、正极反应:Cu2++2e-=Cu。装置图如图所示: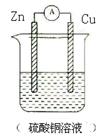
(3)气体的密度之比是相应的相对分子质量之比,所以烷烃的相对分子质量是36×2=72。所以根据烷烃的通式CnH2n+2可知,分子式为C5H12。戊烷有3种同分异构体,其中正戊烷有3种氢原子、异戊烷有4种氢原子,新戊烷有1种。
本题难度:一般
5、填空题 (1)人类的生活和生产活动,可以说都离不开能源。在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是 ;属于“不可再生能源”的是 。(填序号)
(2)甲、乙两种金属: ①甲单质能与乙盐的溶液反应; ②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙; ③分别与氯气反应生成金属阳离子时,甲失去电子数比乙多;④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气。其中一定能说明甲的金属性比乙强的有 。(填序号)
(3)某温度时,在2 L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示。由图中所给数据进行分析,该反应的化学方程式为 ;反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;反应达到平衡时,Y的浓度为 。
参考答案:(每空1分,共6分。答不全或有错误选项的不得分,不写单位或单位写错不得分。)
(1)②⑧; ①④⑤ (2)④
(3)3X+Y 2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。
2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。
本题解析:(1)二级能源是指需要依靠其它能源(也就是一级能源)的能量间接制取的能源,电能、水煤气均属于“二级能源”,不可再生能源泛指人类开发利用后,在现阶段不可能再生的能源资源,如石油、煤炭、天然气等,故属于“二级能源”的是②⑧,属于“不可再生能源”的是①④⑤。
(2)④乙单质表面生成氢气,说明乙是正极,即甲的金属性大于乙的金属性。故选④
(3)根据化学计量数之比等于反应的物质的量之比,故方程式为3X+Y 2Z。
2Z。
v(Z)=△c(Z)÷t=△n(Z) ÷V÷t=0.2mol÷2L÷2min=0.05mol/(L·min)。
平衡时,Y的物质的量为0.9mol,体积为2L,浓度为0.9mol/2L=0.455mol/L。
考点:常见能源的种类及其工作原理 金属性强弱比较 化学反应速率和化学平衡
点评:本题考查学生二级能源和不再生能源的概念,可以根据所学知识进行回答,难度不大。
本题难度:一般