时间:2017-03-05 15:54:33
1、选择题 常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是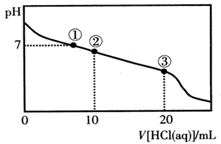
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:C
本题解析:A.点①所示溶液中pH=7,则:c(H+)=c(OH-);根据物料守恒可得c(Na+)=c(Cl-)+c(CH3COO-).盐的电离远大于弱电解质水的电离,因此微粒关系是c(Na+)=c(Cl-)+c(CH3COO-)>c(H+)=c(OH-)。错误。B.点②所示溶液中,由于发生反应:CH3COONa+HCl= CH3COOH+NaCl.由于二者是以2:1物质的量关系混合的,所以反应后的溶液为CH3COONa、CH3COOH、NaCl按照1:1:1的物质的量关系混合。由于CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-) >c(CH3COOH), c(CH3COO-) > c(Cl-);根据物料守恒可得c(Na+) >c(CH3COO-)。因此微粒的关系为c(Na+)>c(CH3COO-) >c(Cl-)>c(CH3COOH)。错误。C.点③所示溶液中恰好发生反应CH3COONa+HCl= CH3COOH+NaCl。得到的溶液为CH3COOH和NaCl的混合溶液。由于CH3COOH要发生电离作用,所以c(Na+)>c(CH3COOH);在溶液中除了醋酸电离产生H+外,还存在水的电离平衡,因此c(H+)>c(CH3COO-);但是醋酸是弱酸,电离程度是微弱的,因此c(CH3COOH)>c(H+)。故微粒关系为: c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)。正确。D.根据物料守恒可得: c(Na+)=c(CH3COO-)+c(CH3COOH)。因此比可能出现c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)。错误。
本题难度:一般
2、选择题 下列对溶液叙述正确的是( )
A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小
B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的PH相等,则m<n
C.常温下,5ml0.02mol/LHCl溶液与5ml0.02mol/LBa(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液的pH=12
D.常温下将稀NaOH溶液与醋酸溶液混合,可能出现PH>7的情况,且c(OH-)>c(Na+)>c(CH3COO-)>c(H+)
参考答案:A.冰醋酸是分子晶体,向冰醋酸中加水,促进冰醋酸电离,氢离子浓度逐渐增大,增大到一定程度时,再向溶液中加水稀释,溶液中离子浓度反而减小,故A错误;
B.一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中促进一水合氨电离,但不能完全电离,所以物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的pH相等,氢氧化钠溶液中加入的水体积大于氨水,则m>n,故B错误;
C.混合溶液中c(OH-)=0.02mol/L×0.005L×2-0.02mol/L×0.005L×10.01L=0.01mol/L,则c(H+)=10-1410-2mol/L=10-12 mol/L,所以pH=12,故C正确;
D.氢氧化钠和醋酸溶液混合,如果pH>7时,溶液中的溶质为醋酸钠或醋酸钠和氢氧化钠,溶液中c(Na+)>c(OH-),但不可能出现c(OH-)>c(Na+),故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
A.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸
B.取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,稀释后两溶液的pH仍然相同,则m>n
C.取等体积的两种酸溶液分别与足量的锌粒反应,生成氢气的体积醋酸大于盐酸
D.取等体积的两种酸溶液分别与NaOH溶液中和,消耗NaOH的物质的量醋酸大于盐酸
参考答案:A
本题解析:醋酸是弱电解质,所以在pH相等的条件下,醋酸的浓度大于盐酸的。选项A不正确,开始时,氢离子浓度相等,反应速率相等;在稀释过程中,醋酸的电离是促进的,所以要使稀释后两溶液的pH仍然相同,则醋酸加的水要多,B正确;醋酸的浓度大,在体积相等的条件下,醋酸产生的氢气多,同样消耗的氢氧化钠也是多,C、D正确,答案选A。
本题难度:一般
4、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH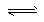 CH3COO-?+ H+,要使溶液中
CH3COO-?+ H+,要使溶液中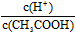 值增大,可以采取的措施是?
值增大,可以采取的措施是?
[? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列事实或变化,能证明一水合氨是弱电解质的是(?)
A.氨水受热分解挥发出氨气
B.氨水与醋 酸反应生成醋酸铵,而醋酸铵是强电解质
酸反应生成醋酸铵,而醋酸铵是强电解质
C.氨水的导电能力弱
D.在氨水溶液中存在NH3·H2O分子
参考答案:B
本题解析:略
本题难度:简单