时间:2017-03-05 15:54:33
1、选择题 HgCl2的稀溶液可用作手术刀的消毒剂,已知HgCl2的熔点是277 ℃,熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,则下列关于HgCl2的叙述中正确的是( )
①HgCl2属于共价化合物 ②HgCl2属于离子化合物 ③HgCl2属于非电解质 ④HgCl2属于弱电解质
A.①③
B.①④
C.②③
D.②④
参考答案:B
本题解析::HgCl2熔点低,熔融状态不导电,说明它属于共价化合物,而不是离子化合物;水溶液有弱的导电能力,说明在水分子作用下微弱电离,属弱电解质,因此答案选B。
点评:该题是中等难度的试题,试题贴近高考,难易适中,注重考查学生分析问题、解决问题的能力,有助于培养学生严谨的逻辑思维能力和创新思维能力,也有利于调动学生的学习兴趣,激发学生的学习求知欲。
本题难度:简单
2、填空题 (Ⅰ)(9分)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜?⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①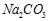 ?②
?②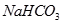 ?③
?③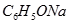 ?④
?④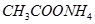 ?⑤
?⑤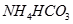 ?(已知酸性
?(已知酸性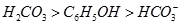 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)?。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)?>?>?。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式?。
参考答案:(Ⅰ)⑤⑦⑧;③;②;(每空1分)
(Ⅱ)(1)②④⑤?(2)①>③>②(每空2分)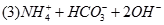

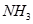 ↑
↑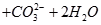
本题解析:本题考查电解质、强弱电解质概念,可以从物质分类的角度来看,强电解质为活泼金属氧化物、强酸、强碱和大多数盐,弱电解质为弱酸、弱碱和水,非电解质非金属氧化物、大多数非金属氧化物。电解质在熔融或水溶液中电离出阴阳离子,能够导电。
本题难度:一般
3、填空题 甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是??。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH?1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法:?。
(3)乙方案中,说明HA是弱电解质的现象是?
?。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述:??。
参考答案:⑴ 100mL容量瓶(2分)
⑵ >(1分)?
取一小段pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在pH试纸中央,对照比色卡,读出溶液的pH(2分)
⑶ 装HA溶液的试管中放出H2的速率快(2分)
⑷ 用蒸馏水配制少量NaA溶液,再测其pH,若pH>7,说明HA是弱电解质?(2分,其他合理答案均可给分)
本题解析:(1)配制的溶液体积为100ml,所以使用100ml容量瓶。
(2)若HA是弱电质,则发生不完全电离,0.1 mol?L?1的HA电离出的H+的浓度小于0.1mol?L?1,pH>1;pH试纸的使用方法回答要点要全面。
(3)配制的两种酸pH相同,加水稀释弱电解质的电离平衡向右移动,弱电解质的H+浓度更大,装HA溶液的试管中放出H2的速率快,可证明HA为弱电解质。
(4)利用盐类的水解,测量NaA溶液的酸碱性可证明HA为弱电解质。
本题难度:一般
4、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是
A.c(HSO3-) > c(SO32-) > c(H2SO3)
B.c(Na+) = c(HSO3-) + 2c(SO32-) + c(HSO3)
C.c(Na+) = c(HSO3-) > c(H+) > c(OH-)
D.c(Na+) + c(H+) = c(HSO3-) + c(OH-) + c(SO32-)
参考答案:A
本题解析:NaHSO3溶液呈酸性,表明HSO3-的电离程度大于水解程度,但是电离和水解都比较微弱,所以A对;B项结合物料守恒,应该为c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3);C项应为c(Na+)>c(HSO3-) > c(H+) > c(OH-);结合电荷守恒可知D项错误,应为c(Na+) + c(H+) = c(HSO3-) + c(OH-) +2 c(SO32-).
考点:离子浓度大小的比较。
本题难度:一般
5、填空题 25℃时,0.1mol/L的CH3COOH溶液中,c(H+)=1.0×10-3mol/L(水的电离可忽略),
(1)求该温度下CH3COOH的电离度;
(2)求CH3COOH的电离常数?(只列出计算式,不用计算结果)
参考答案:(1)由CH3COOH?CH3COO-+H+知,c(H+)等于已经电离的c(CH3COOH),所以已经电离的醋酸浓度是1.0×10-3mol/L,
所以α=已电离的醋酸分子醋酸分子总数×100%=1×10-3mol/L0.1mol/L×100%=1%;
答:该温度下CH3COOH的电离度为1%;
(2)由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的c(CH3COOH),溶液中未电离的醋酸浓度为(0.1-0.001)mol/L,Ka=C(H+).C(CH3COO-)C(CH3COOH),
答:CH3COOH的电离常数Ka为C(H+).C(CH3COO-)C(CH3COOH).
本题解析:
本题难度:一般