时间:2017-03-05 15:49:18
1、推断题 在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置__________________; D元素基态原子电子排布式为___________________。
(2)E的氢化物在同族元素中沸点最高的原因是_____________________。
(3)A、C两元素第一电离能_______>_______。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤电子对的原子或离子,另一方是___________的原子。
(5)A元素可与氢元素形成离子化合物,电子式为____________;这种离子化合物可与水反应,化学方程式为________________________。
参考答案:
(1)第4周期ⅡB族;1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5
(2)E的氢化物分子间存在氢键,破坏它需要较高的能量,所以沸点较高
(3)Ca;K
(4)具有能够接受孤电子对的空轨道
(5)[H:]-Ca2+[:H]-;CaH2+2H2O = Ca(OH)2+2H2↑
本题解析:
本题难度:一般
2、选择题 钛(22Ti)金属常被称为未来钢铁。钛有46Ti、47Ti、48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是
[? ]
A.以上五种钛原子中,中子数不可能为22
B.钛元素在周期表中处于第四周期
C.钛的不同同位素在周期表中处于不同的位置
D.钛元素是属于d区的过渡元素
参考答案:C
本题解析:
本题难度:简单
3、简答题 在第三周期中,置换氢气能力最强的元素的符号为______,化学性质最稳定的元素的符号是______,最高价氧化物的水化物酸性最强的酸的化学式是______,碱性最强的碱的化学式是______,显两性的氢氧化物的化学式是______,该两性氢氧化物与盐酸、烧碱溶液分别反应的离子方程式为______、______.原子半径最小的金属离子结构示意图为______.
参考答案:根据同周期元素性质的递变规律,由钠到氯原子半径依次减小,金属的还原性减弱,置换氢气的能力减弱,所以置换氢气能力最强的元素是Na,由钠到氯,最高价氧化物对应的水化物的酸性增强,酸性最强的酸是高氯酸,由钠到氯,最高价氧化物对应的水化物的碱性减弱,碱性最强的碱是氢氧化钠,氢氧化铝是两性氢氧化物,能和强酸、强碱反应,
从Na+到Al3+,P3-到Cl-半径也分别依次减小,半径最小的金属离子是铝离子,其离子结构示意图为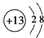
.
故答案为:Na;Ar;HClO4;NaOH;Al(OH)3;Al(OH)3+3H+═Al3++3H2O、Al(OH)3+OH-═[Al(OH)4]-;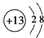
.
本题解析:
本题难度:一般
4、选择题 下列关于化学观或化学研究方法的叙述,错误的是( )
A.根据元素周期律,由HClO4可类推出氟元素也存在最高价氧化物的水化物HFO4
B.在元素周期表的金属和非金属分界线附近寻找半导体材料
C.控制实验条件可以改变可逆反应的限度和速率
D.在化工生产中应遵循“绿色化学”的思想
参考答案:A.Cl有最高价含氧酸,但F没有正价,则不存在最高价含氧酸,故A错误;
B.在元素周期表的金属和非金属分界线附近的元素既有金属性又有非金属性,则可寻找半导体材料,故B正确;
C.如温度能改变可逆反应的限度和速率,故C正确;
D.化工生产排放三废污染环境,则在化工生产中应遵循“绿色化学”的思想,减少污染物的排放,故D正确;
故选A.
本题解析:
本题难度:一般
5、填空题 X、Y、Z是中学化学常见的三 种元素,其中,X、Z位于短周期。常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13。请回答下列问题:
(1)Z在元素周期表中的位置是_________ ,X单质分子的电子式是_________。
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应的化学方程式是___________。
(3)含上述元素的某些物质常用于处理工业废水,部分流程如下图: 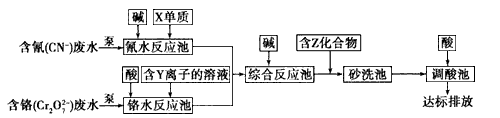
①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1 mol电子时,有____________ mol Cr2O72-转化(计算结果保留两位小数)。
②含Z化合物可以使水中的悬浮颗粒发生凝聚,原因是 ______________(用文字和化学方程式表示)。
③处理含氰废水时,CN-最终转化为两种无毒气体,该反应的离子方程式是_______________。
(4)利用下图装置电解可得到一种新型净水剂K2YO4,阳极的电极反应式为______________。 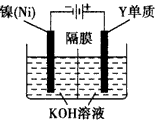
参考答案:(1)第3周期ⅢA族;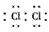
(2) Fe2O3 + 2 Al  Al2O3 +3Fe或 3Fe3O4 +8Al
Al2O3 +3Fe或 3Fe3O4 +8Al  4Al2O3+9Fe
4Al2O3+9Fe
或3FeO +2Al Al2O3 + 3Fe
Al2O3 + 3Fe
(3)①0.17
②Al3+ + 3H2O 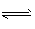 Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒,使之沉淀下来
Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒,使之沉淀下来
③2CN - +5Cl2 +8OH- ==2CO2 + N2 +4H2O + 10Cl-
(4)Fe-6e- +8OH- == FeO42- + 4H2O
本题解析:
本题难度:困难