时间:2017-03-05 15:41:45
1、选择题 图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.三种元素中,Y的最高价氧化物对应的水化物酸性最强
D.ZM2分子中各原子的最外层均满足8电子稳定结构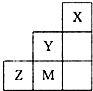
参考答案:由X、Y、Z、M在短周期的相对位置可知,X为氦元素、Y为氟元素、Z为硫元素、M为氯元素.
A、同周期随原子序数增大非金属性增强,非金属性M>Z,同主族自上而下非金属性减弱,非金属性Y>M,所以非金属性Y>M>Z,故A错误;
B、电子排布相同,核电荷数越大离子半径越小,所以离子半径S2->Cl-,最外层电子数相同,电子层越大离子半径越大,所以离子半径,Cl->F-,故离子半径径S2->Cl->F-,故B错误;
C、氟元素没有正化合价,Cl的最高价氧化物对应的水化物酸性最强,故C错误;
D、SCl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子呈2个S-Cl键,分子中各原子的最外层均满足8电子稳定结构,故D正确.
故选:D.
本题解析:
本题难度:简单
2、选择题 下列物质中有氧离子的是( )
A.氧化镁
B.一氧化氮
C.氯酸钾
D.磷酸
参考答案:A
本题解析:
本题难度:简单
3、选择题 同一周期的两主族元素A、B能形成AB2型离子化合物,A、B元素在周期表中的族序数可能为( )
A.ⅡA、ⅦA
B.IA、ⅦA
C.ⅣA、ⅥA
D.IA、VA
参考答案:由同一周期的两主族元素A、B能形成AB2型离子化合物,
则A为+2价,A在元素周期表中的第ⅡA族,
B为-1价,其最高价为+7价,则B在元素周期表中的第ⅤⅡA族,
故选A.
本题解析:
本题难度:简单
4、填空题 (下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ ⑩ |
参考答案:由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)Ar的最外层电子数为8,为稳定结构,则化学性质不活泼,其原子结构示意图为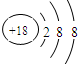
,故答案为: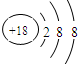
;
(2)上述元素中只有Al的氢氧化物为两性,氢氧化铝与HCl反应生成氯化铝和水,
其离子反应为Al(OH)?3+3H+═Al3++3H2O,故答案为:Al;Al(OH)?3+3H+═Al3++3H2O;
(3)氯化镁为离子化合物,其电子式为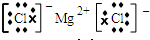
,故答案为: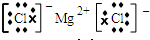
;
(4)非金属性越强,则元素的最高价氧化物的水化物中酸性越强,Cl、S、N、C中非金属性最强的为Cl,其最高价氧化物的水化物为HClO4,故答案为:HClO4;?
(5)F的核电荷数为9,Br的核电荷数为35,则35-9=26,故答案为:26;?
(6)同周期元素从左到右金属性在减弱,则金属性Mg>Al,可利用金属单质与水、酸或最高价氧化物对应水化物的碱性来比较金属性,则b、c可以,故答案为:镁;b、c.
本题解析:
本题难度:简单
5、选择题 下列物质中属于只含有共价键的化合物的是
[? ]
A.HI?
B.NaOH?
C.Br2? ?
D.NaCl
参考答案:A
本题解析:
本题难度:简单