时间:2017-03-05 15:39:47
1、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s)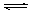 Al(OH)3(aq)
Al(OH)3(aq) 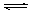 Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分) A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s)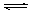 Al(OH)3(aq)
Al(OH)3(aq) 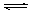 Al3++3OH-,前者为溶解平衡,后者为电离平衡;C错,除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;D正确,沉淀反应中常加过量的沉淀剂,其目的是使沉淀尽可能完全;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;C错,除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;D正确,沉淀反应中常加过量的沉淀剂,其目的是使沉淀尽可能完全;
本题难度:一般
2、选择题 已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是
A.x数值为1.4×10-5
B.b点与d点对应的溶度积相等
C.加入蒸馏水可使溶液由d点变到a点
D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等
参考答案:B
本题解析:CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4?mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5?mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5?mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
本题难度:一般
3、选择题 工业制氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
为除去溶液中的Fe2+,可以采用的方法是(? )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.通入适量Cl2,再加碱调整溶液的pH为4
D.直接加铁粉将Cu2+还原出来
参考答案:C
本题解析:由Fe3+、Fe2+、Cu2+完全沉淀的pH大小可知,应先将Fe2+氧化为Fe3+,再加碱调整溶液的pH生成Fe(OH)3沉淀,从而实现Fe2+和Cu2+分离。
本题难度:简单
4、选择题 下列实验操作对应的实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 把S02通人紫色石蕊试液中 | 紫色褪去 | S02具有漂白性 |
| B | 向NaOH溶液中滴加足量的MgCl2溶液, 然后再滴加足量的CuCl2溶液 | 先产生白色沉淀,然 后沉淀变蓝色 | 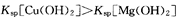 |
| C | 向某溶液中滴加KSCN溶液 | 溶液变红色 | 溶液中含有Fe2+ |
| D | 将充满N02的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4的△H<0 |
参考答案:D
本题解析:A.SO2不能使酸碱指示剂褪色,实验现象不正确,故A错。B.由实验现象先产生白色沉淀,然后沉淀变蓝色,可知Mg(OH)2转化为Cu(OH)2,Ksp[Mg(OH)2]> Ksp[Cu(OH)2],故B错误。C.向某溶液中滴加KSCN溶液溶液变红色说明溶液中含有Fe3+,故C错;D.将充满N02的密闭玻璃球浸泡在热水中颜色加深,说明2NO2?N2O4向逆反应方向移动,2NO2?N2O4为放热反应即△H<0,故D正确;
考点:了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。认识化学是以实验为基础的一门科学。
点评:本题考查SO2的漂白性、溶度积及沉淀转换、三价铁离子的检验、化学平衡移动等知识点。
本题难度:一般
5、选择题 已知常温下:Ksp〔Mg(OH)2〕=1.8×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12 ,
Ksp(CH3COOAg)=2.3×10-3。下列叙述正确的是
[? ]
A.等体积混合浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀
C.在Mg2+为0.121 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
参考答案:AC
本题解析:
本题难度:一般