时间:2017-03-05 15:35:48
1、填空题 (2分)由铜、银和硝酸银溶液组成的原电池中,负极反应式为 ,正极反应式为 。
参考答案:(2分)负极:Cu-2e— ="=" Cu2+ 正极:2Ag++2e— ="=" 2Ag
本题解析:略
本题难度:一般
2、选择题 关于右图所示装置的叙述错误的是( )
A.锌是负极,其质量逐渐减小
B.氢离子在铜表面被还原
C.电子从锌片经导线流向铜片
D.电流从锌片经导线流向铜片
参考答案:A、锌是负极,锌失电子生成锌离子进入溶液,所以质量逐渐减小,故A正确;
B、铜是正极,正极上氢离子得电子发生还原反应生成氢气,所以氢离子在铜表面被还原,故B正确;
C、电子从负极沿导线流向正极,所以电子从锌片经导线流向铜片,故C正确;
D、电流流向和电子流向相反,所以电流流向是从铜片沿导线流向锌片,故D错误;
故选D.
本题解析:
本题难度:简单
3、选择题 下图是水煤气(成分为CO、H2)、空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是
A.A处通入的是空气,B处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下的水煤气2.24 L
D.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O
参考答案:C
本题解析:本题考查的是原电池的应用-燃料电池的工作原理。不管什么燃料电池,若需要消耗氧气,那么通O2的这一极一定是正极。正极得电子,发生还原反应。负极失电子,发生氧化反应。外电路中电子由负极经过导线回到正极。而内电路(溶液中)靠离子定向移动产生电流。电子的流向可知,电子从a极出来,回到b极。所以a是负极(燃料失电子),b极是正极(O2得电子)。故A错误。负极电极反应式:不仅CO失电子,还有H2失电子。CO失电子后变成+4价(以CO2形式存在)而电解质溶液是碱性溶液,所以CO2会与OH-发生反应生成CO32-。故电极反应为:CO+4OH--2e-= CO32-+2H2O。配平时不仅满足电子守恒,还有电荷守恒和原子守恒。同理可写出H2的反应:H2+2OH--2e-=2H2O。所以漏了H2的反应式。故B错误。如用这种电池电镀铜,当镀件增重6.4gCu,说明n(Cu)=0.1mol。转移n(e-)=0.2mol。1molCO转移2mol e-,1mol H2转移2mol e-。1molCO和H2的混合气体也是转移2mol e-。现增重6.4gCu,转移0.2mol e-,所以消耗CO? 0.1mol或0.1mol H2或CO和H2的混合气体0.1mol。故C正确。a电极是负极,发生氧化反应。b电极是正极,得到电子,发生还原反应。故D错误。
本题难度:一般
4、填空题 (8分)请根据反应:Fe + Cu2+ = Fe 2++ Cu 设计原电池:
(1) (2分)画出实验的简易装置图:(用铅笔画图)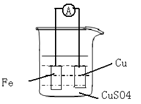
(2)(6分)写出电极反应式,正极: ,负极: 。当反应进行到一段时间后取出电极材料,测得某一电极增重了6.4g,则反应共转移了的电子数是 。
参考答案:(2) Cu2+ + 2e- = Cu 、 Fe
本题解析:
本题难度:一般
5、选择题 根据下列事实,判断离子的氧化性顺序为①A+B2+=A2++B②D+2H2O=D(OH)2+H2↑③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+( )
A.E2+>B2+>A2+>D2+
B.D2+>E2+>A2+>B2+
C.D2+>A2+>B2+>E2+
D.A2+>B2+>D2+>E2+
参考答案:①A+B2+=A2++B中,氧化性B2+>A2+,
②D+2H2O=D(OH)2+H2↑中,氧化性H+>D2+,
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+,氧化性E2+>B2+,
所以这几种离子的氧化性大小顺序为:E2+>B2+>A2+>D2+,
故选A.
本题解析:
本题难度:简单