时间:2017-03-05 15:34:44
1、选择题 NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子.根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不含有H原子的分子是非极性分子
B.在ABn分子中A的原子量小于B的原子量时为非极性分子
C.ABn分子中每个共价键的键长都相等的分子是非极性分子
D.在ABn分子中A原子的所有价电子都参与成键的是非极性分子
参考答案:A、分子中不含有H原子的分子不一定是非极性分子,如PCl3是极性分子,故A错误.
B、PCl3分子中P原子量小于氯原子,但PCl3是极性分子,故B错误.
C、H2S分子中两个S-H键的键长都相等,但硫化氢分子是极性分子,故C错误.
D、在ABn分子中A原子的所有价电子都构成共价键,导致结构对称、正负电荷重心重叠,所以为非极性分子,故D正确.
故选D.
本题解析:
本题难度:简单
2、填空题 (14分)有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大。B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z。
请回答下列问题:
G的原子结构示意图为?,A2D2电子式为??,
BD2的结构式为?,Q的分子空间结构为?。
(2)固体Z为?晶体(填晶体类型),Z中所含化学键类型有?。
(3)在D同主族元素氢化物中,Y的沸点反常,原因是?。
(4)B、F、G元素非金属性由强到弱的顺序为?,若用下图装置验证这三种元素非金属性强弱,则在装置中加入的试剂分别为:Ⅰ?,Ⅱ?,Ⅲ?。(填化学式)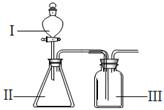
参考答案:(1) ,
,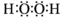 ,O=C=O,正四面体形。(2) 离子晶体,?离子键?极性键 (配位键) 。
,O=C=O,正四面体形。(2) 离子晶体,?离子键?极性键 (配位键) 。
(3)原因是 H2O分子间存在氢键 ;
(4)? Cl 、C 、Si;ⅠHClO4;ⅡNa2CO3或NaHCO3;Ⅲ? Na2SiO3
本题解析:根据题意可得:A是H;B是C;C是N;D是O;E是F是Si;G是Cl;Q是CH4;X是NH3;Y是H2O;Z是NH4Cl。(1)Cl的原子结构示意图为 ; H2O2电子式为
; H2O2电子式为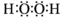 ; CO2的结构式为O="C=O;" CH4的分子空间结构为正四面体形.C在正四面体几何中心,四个H原子在四面体的顶点上。(2)固体NH4Cl为离子晶体,在该晶体中含有离子键、极性共价键、配位键。(3)在O同主族元素氢化物中,H2O是液态,而H2S、H2Se都是气态,水的沸点反常,原因是是在H2O的分子之间除了存在分子间作用力外,分子间存在氢键 ;(4)C、Si是同一主族的元素,从上到下,元素的非金属性逐渐减弱,所以非金属性C>Si;元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,酸性HClO4>H2CO3.所以非金属性Cl>C。因此元素的非金属性:Cl > C > Si。若用图示装置验证这三种元素非金属性强弱,则应该利用强酸制取弱酸的。在装置中加入的试剂分别为Ⅰ中HClO4;Ⅱ中Na2CO3或NaHCO3;Ⅲ 中Na2SiO3。
; CO2的结构式为O="C=O;" CH4的分子空间结构为正四面体形.C在正四面体几何中心,四个H原子在四面体的顶点上。(2)固体NH4Cl为离子晶体,在该晶体中含有离子键、极性共价键、配位键。(3)在O同主族元素氢化物中,H2O是液态,而H2S、H2Se都是气态,水的沸点反常,原因是是在H2O的分子之间除了存在分子间作用力外,分子间存在氢键 ;(4)C、Si是同一主族的元素,从上到下,元素的非金属性逐渐减弱,所以非金属性C>Si;元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,酸性HClO4>H2CO3.所以非金属性Cl>C。因此元素的非金属性:Cl > C > Si。若用图示装置验证这三种元素非金属性强弱,则应该利用强酸制取弱酸的。在装置中加入的试剂分别为Ⅰ中HClO4;Ⅱ中Na2CO3或NaHCO3;Ⅲ 中Na2SiO3。
本题难度:一般
3、推断题 A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为?。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为?,1mol该分子中含有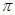 键的数目为?。
键的数目为?。
(3)基态D原子的外围电子排布式为?。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于?晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是?。 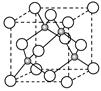 ?
?
参考答案:(12分)
A:(1)C<O<N(2分)
(2)N≡C-C≡N (2分)? 4NA(或2.408×1024)(2分)
(3)3d54s1(2分) 分子(2分)
(4)CuH(2分)
本题解析:A为C、B为N,C为O,D是Cr,E为Cu,⑴同一周期第一电离能由小变大,其中N的2P轨道是半满状态,第一电离能变大,答案:C<O<N;CN―与N2为等电子体,C与N之间形成叁键,结构式为N≡C-C≡N,其中每个分子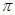 键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
本题难度:一般
4、选择题 Cs是ⅠA族元素,F是ⅦA族元素,估计Cs和F形成的化合物可能是
A.离子化合物
B.化学式为CsF2
C.共价化合物
D.室温为气体
参考答案:A
本题解析:Cs是ⅠA族元素容易失去一个电子形成阳离子,F是ⅦA族元素,容易得到一个电子形成阴离子,故Cs和F形成的应为离子化合物,化学式为CsF,它在室温时以固体形式存在,形成离子晶体。
本题难度:简单
5、填空题 化合物A是一种不稳定的物质,它的分子组成可用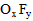 表示,10mL A气体能分解生成15mLO2和10mLF2
表示,10mL A气体能分解生成15mLO2和10mLF2
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…-O-O-O-…链状排列,则A分子的电子式____________________,结构式是_____________________。
参考答案:(1)O3F2
(2)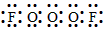 ;F-O-O-O-F
;F-O-O-O-F
本题解析:
本题难度:一般