时间:2017-03-05 15:20:51
1、选择题 氨水、苛性钠、盐酸中任何一种溶液作试剂都能被鉴别的溶液组是:
A.Na2CO3和NaCl
B.Al(NO3)3和AgNO3
C.Fe2(SO4)3和FeCl3
D.NH4Cl和MgCl2
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列元素的原子半径最小的是
A.N
B.P
C.Se
D.Te
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列各组性质比较的表示中,正确的是
A.还原性:HF>HCl>HBr>HI
B.稳定性:HF
D.密度:F2
参考答案:D
本题解析:
A.非金属性:F>CI>Br>I,根据易得不易失,易失不易得原则,F原子最容易得电子,得电子后也就最不容易失电子,离子的还原性:F-<CI-<Br-<I-。
B.非金属性越强,生成的气态氢化物越稳定,稳定性:HF>HCI>HBr>HI。
C.非金属性越强,与水反应越容易:F2>Cl2>Br2>I2。
本题难度:简单
4、选择题 下列气体有色、有毒的是
A.Cl2
B.CO
C.N2
D.CO2
参考答案:A
本题解析:有毒的气体是Cl2和CO,Cl2为黄绿色,CO无色.
本题难度:困难
5、选择题 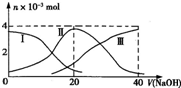 常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表
常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表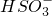 、Ⅲ代表
、Ⅲ代表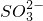 ).根据图示下列判断正确的是
).根据图示下列判断正确的是
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12?
B.当V(NaOH)=20?mL时:c(Na+)>c()>c(H+)>c()>c(OH-)
C.当V(NaOH)=40?mL时2c(Na+)=c()
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,溶液的温度会继续升高
参考答案:B
本题解析:分析:A.当V(NaOH)=0时,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=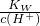 ;
;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,电离为主,溶液显酸性;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应.
解答:A.当V(NaOH)=0时,由图象可知,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=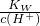 ≠1.0×10-12mol/L,故A错误;
≠1.0×10-12mol/L,故A错误;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,HSO3-电离大于水解,溶液显酸性,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主,则c(Na+)>2c(SO32-),故C错误;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应,所以温度变化不明显,不会继续升高,故D错误;
故选B.
点评:本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等.
本题难度:困难