时间:2017-03-05 15:11:21
1、选择题 SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)==SF6(g)的反应热ΔH为
[? ]
A. -1780kJ·mol-1
B. -1220kJ·mol-1
C. -450 kJ·mol-1
D. +430kJ·mol-1
参考答案:B
本题解析:
本题难度:一般
2、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/°C | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
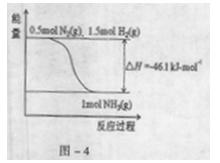
 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。参考答案:
本题解析:略
本题难度:一般
3、选择题 下列描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.中和反应都是放热反应
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
参考答案:B
本题解析:A、有些放热反应也需要加热,不选A;B、中和反应都是放热反应,选B;C、反应的速率取决于反应物的性质,不选C;D、反应热和反应的条件没有关系,不选D。
考点:反应的热效应。
本题难度:一般
4、选择题 下列晶体或分子中,含有化学键类型有差异的一组是
A.NH3、NO2。
B.NaCl、KF
C.NaOH、Ca(OH)2
D.MgO、H2O2
参考答案:D
本题解析:A. NH3、NO2都是由极性共价键构成的极性分子。错误。B.NaCl和KF都是由离子键构成的离子晶体。错误。C. 在NaOH和Ca(OH)2中含有离子键、极性共价键,属于离子晶体。错误。D.MgO是离子化合物,含有离子键; H2O2?是共价化合物,含有极性共价键、非极性共价键。含有化学键类型有差异。正确。
本题难度:一般
5、实验题 某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g。
Ⅱ.测定中和热的实验装置如图所示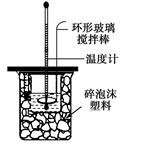
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3 kJ/mol):________ 。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ. 5.0
Ⅱ.(1) 。
。
(2)①4.0 ②-53.5 kJ/mol ③acd
本题解析:Ⅰ、要使用245 mL NaOH溶液,需要配制250mL溶液,所以需要氢氧化钠
m=cvM=0.50×0.25×40=5.0g;
Ⅱ、(1)中和热是指稀强酸和稀强碱反应生成1mol水所放出的能量,稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 ;(2)①根据表中数据,平均温差4.0℃;②根据题意,生成0.025mol水放出热量为4.18×80×4=1337.6J,生成1mol水放出热量为1.3376kJ÷0.025=53.504 kJ,中和热ΔH=-53.5kJ/mol。③隔热效果差,热量散失实验结果偏低;量取NaOH溶液的体积时仰视读数,量取的氢氧化钠偏多,实验结果偏高;分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失多,实验结果偏低;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,氢氧化钠和硫酸反应放热,使硫酸起始温度升高,温差缩小实验结果偏低,产生偏差的原因可能是acd
;(2)①根据表中数据,平均温差4.0℃;②根据题意,生成0.025mol水放出热量为4.18×80×4=1337.6J,生成1mol水放出热量为1.3376kJ÷0.025=53.504 kJ,中和热ΔH=-53.5kJ/mol。③隔热效果差,热量散失实验结果偏低;量取NaOH溶液的体积时仰视读数,量取的氢氧化钠偏多,实验结果偏高;分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失多,实验结果偏低;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,氢氧化钠和硫酸反应放热,使硫酸起始温度升高,温差缩小实验结果偏低,产生偏差的原因可能是acd
考点:本题考查溶液配制、中和热测定。
本题难度:一般