时间:2017-03-05 14:43:18
1、选择题 若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10∶1
B.5∶1
C.1∶1
D.1∶10
参考答案:B
本题解析:H2SO4+2NaOH=Na2SO4+2H2O,所以硫酸与氢氧化钠物质的量之比是1:2;设硫酸的物质的量浓度为c,体积为V,氢氧化钠溶液浓度为10-3mol/l,体积为10V,则硫酸与氢氧化钠物质的量之比= =1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。
=1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。
考点:考查酸碱混合时的定性判断及有关ph的计算。
本题难度:一般
2、选择题 下列电离方程式错误的是?( )
A.CaCl2=Ca2++2Cl-
B.KClO3=K++Cl-+3O2-
C.HNO3=H++NO3-
D.NaHSO4=Na++H++SO42-
参考答案:B
本题解析:
本题难度:简单
3、填空题 ( 12分)
(1)二甲醚燃料电池的正极反应式为 。电池在放电过程中,负极周围溶液的pH 。(填“增大”、“减小” 或“不变”)
(2)以上述电池为电源,通过导线电解池相连。两极为石墨,电解质溶液为1L
0.1mol/LKCl溶液,写出电解总反应的离子方程式为 。
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到右图(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。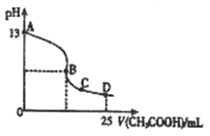
①若图中的B点pH=7,则滴定终点在 区间(填 “AB”、“BC”或“CD”)。
B点溶液中离子浓度大小为 。
②D点溶液中C(HAc) C(Ac_ )(填> 、< 或= )。
参考答案:(12分)(1)O2+4H++4e-=2H2O 减小
(2)2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
(3)①AB c(CH3COO-)=c(K+>c(H+)=c(OH-) ②<
本题解析:(1)原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。再氧气在正极通入,二甲醚在负极。所以正极的电极反应式是O2+4H++4e-=2H2O,负极电极反应式是CH3OCH3+3H2O=2CO2+12e-+12H+,因此电池在放电过程中,负极周围溶液的pH减小。
(2)惰性电极电解氯化钾溶液时,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以总的反应式是2Cl-+2H2O H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。
(3)①醋酸是弱酸,因此当醋酸与氢氧化钾恰好反应时,生成的醋酸钾水解,溶液显碱性。由于B点pH=7,所以滴定终点在AB之间;溶液显中性,根据电荷守恒定律可知,此时在B点离子浓度大小顺序是c(CH3COO-)=c(K+>c(H+)=c(OH-)。
②根据图像可知,氢氧化钾的浓度是0.1mol/L,所以D点溶液中含有的溶质是醋酸和醋酸钾。由于溶液显酸性,这说明醋酸的电离程度大于醋酸钾的水解程度,因此c(HAc)<c(Ac_)。
本题难度:困难
4、填空题 现有200 mL 1mol/L H2SO4溶液,回答下列问题:
(1)写出H2SO4的电离方程式___________________
(2)该H2SO4溶液中H+的物质的量浓度是___________________
(3)请设计一个实验方案,证明此溶液中含有H+和SO42-离子___________________
(4)用此H2SO4溶液和足量金属Zn反应,可以得到标准状况下气体多少升?
______________________________________
参考答案:(1)H2SO4==2H++SO42-
(2)2mol/L
(3)分别取少量试液于试管中,分别加入紫色石蕊试液和盐酸酸化的氯化钡溶液,如果溶液变红,说明有H+,有白色沉淀生成,说明有SO42-
(4)4.48L
本题解析:
本题难度:一般
5、选择题 关于常温下0.1 mol·L-1醋酸钠溶液,下列说法正确的是
A.水电离出来的c(OH-)=1.0×10-13 mol·L-1
B.该溶液的pH<13
C.溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入等浓度等体积的盐酸,溶液中:c(CH3COOH)+ c(CH3COO-)= c(Cl-)+ c(Na+)
参考答案:BC
本题解析:A、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解促进水的电离,水电离出来的c(OH-)远大于1.0×10-13 mol·L-1,错误;B、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解呈碱性,但醋酸根的水解微弱,该溶液的pH<13,正确;C、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解呈碱性,溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),正确;D、加入等浓度等体积的盐酸,所得溶液为等浓度的醋酸和氯化钠的混合液,溶液中:2c(CH3COOH)+ 2c(CH3COO-)= c(Cl-)+ c(Na+),错误。
考点:考查盐类的水解。
本题难度:一般