时间:2017-03-05 14:35:24
1、推断题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的2倍。这四种元素的单质中常温下有两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
(1)写出元素符号:A_______B_______C_______D_______。
(2)写出两种均含A、B、C、D四种元素的化合物相互反应放出气体的化学方程式:_________________________________。
(3)用电子式表示化合物C2D形成过程_________________________________。
(4)用A和B两元素的单质可以制成燃料电池,电池中装有浓KOH溶液。用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是:____________________________。
2、填空题 下表为周期表的一部分,表中所列的字母分别代表一种化学元素。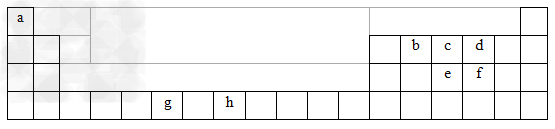
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,h2+中未成对电子数为? 。
(2)在b2a2分子中,元素b为? 杂化,该分子是?分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为? 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是? 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是?。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为? ,其熔点比金刚石?(填“高”或“低”)。
3、选择题 两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:①m-4?②m+4?③m+8?④m-2?⑤m+6.其中正确的组合是( )
A.①②④
B.①②③④⑤
C.①②③⑤
D.①②⑤
4、选择题 元素周期表是一座开放的“元素大厦”,元素大厦尚未客满.若发现117号元素,请您在元素大厦中安排好它的“房间”( )
A.第七周期第0族
B.第六周期ⅡA族
C.第八周期第ⅠA族
D.第七周期第ⅦA族
5、推断题 (三选一)【选修3:选修物质结构与性质】
已知:A、B、C、E四种短周期元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,?C元素的基态原子L层只有2对成对电子,E元素在第三周期元素中电负性最大。D元素的化合物D3C4具有磁性。
(1)分子式为BC2的空间构型为___________;E元素原子的电子排布式为____________。
(2)?某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有________个σ键,?___________个π键;?其中心原子的杂化类型为____________。
(3)同质量的A2C晶体的密度小于液体(4℃时)的密度,其原因是____________。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子式是__________?,属于___________分子(填:“极性”或“非极性”),该反应的化学方程式是____________________。
(5)①?D与水蒸气反应的化学方程式为_____________;?
②?已知D(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(CO)5晶体属于_____________(填晶体类型)。