时间:2017-03-05 14:35:24
1、选择题 X和Y均为短周期元素,已知:aXn-比bXm+多两个电子层,则下列说法正确的是
A.X只能位于第三周期
B.Y不可能位于第二周期
C.b>5
D.a+n+m-b=10或者16
参考答案:D
本题解析:
本题难度:困难
2、选择题 R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R、M的最高价氧化物水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
参考答案:A.同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化物的碱性逐渐减弱,故A正确;
B.若HnJOm为强酸,如J为S元素,则G可能为Si,故B错误;
C.若T的最低化合价为-3,则J的最高正化合价为+7,故C错误;
D.若M的最高正化合价为+4,R可能为Na、Mg、Al等金属元素,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 与氢氧根离子具有相同的质子数和电子数的微粒是
A.CH4
B.NH4+
C.NH2-
D.Cl-
参考答案:C
本题解析:OH-的质子数和电子数分别是9和10,A~D中的质子数和电子数分别是10和10、11和10、9和10、17和18.所以答案选C。
本题难度:一般
4、选择题 氢元素位于元素周期表中的第ⅠA族,按其结构与性质,也可以放在第ⅦA族,能支持此种说法的是
A.HCl
B.NaH
C.H2O2
D.H2
参考答案:B
本题解析:ⅦA族元素可呈现—1价,而在NaH中氢元素也呈现—1价,故答案为B
本题难度:困难
5、填空题 (1)下表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)
(2)元素甲是第三周期原子半径最小的主族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式______,
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在甲单质中加热反应生成B的形成过程______.
丙在空气中加热反应生成的物质中含有的化学键是______.
写出乙、丙两种元素的最高价氧化物的水化物相互反应的离子方程式:______.
(4)丁元素与丙元素同族并位于其下一周期,写出它与冷水反应的化学方程式:______. 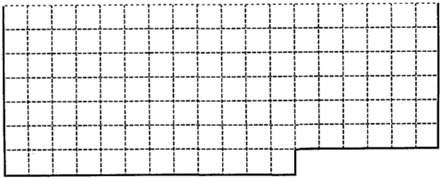
参考答案:(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下: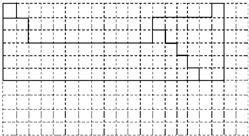
,
故答案为:
;
(2)第三周期原子半径最小的主族元素是Cl,由Cl元素等非金属元素组成的离子化合物是氯化铵,故答案为:NH4Cl;
(3)第三周期原子半径最小的金属元素是Al,短周期元素中原子半径最大的元素是Na,金属钠和氯气反应生成氯化钠,是钠离子和氯离子间通过静电作用形成的离子化合物,其中含有离子键,用电子式表示化合物的形成过程为Na?+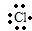
→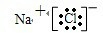
,
钠元素最高价氧化物的水化物是氢氧化钠,铝元素的最高价氧化物的水化物是氢氧化铝,二者之间的反应离子方程式为:Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Na?+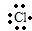
→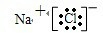
;离子键;Al(OH)3+OH-=[Al(OH)4]-;
(4)钾元素和钠元素位于同一主族,并且钾在钠的下一周期,钾和水的反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑.
本题解析:
本题难度:一般