时间:2017-03-05 14:28:50
1、简答题 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
? |
参考答案:(1)氧化还原反应4FeS2+11O2?高温?.?8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,该反应生成8mol的二氧化硫,转移电子的物质的量为44mol,所以当该反应转移2.75mol电子时,生成的二氧化硫的物质的量为0.5mol,在标准状况下的体积为11.2L,故答案为:Fe、S;11.2;
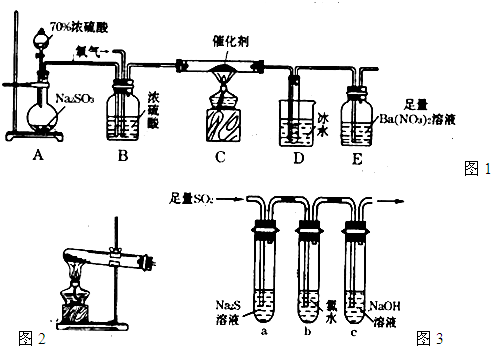
(2)①分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加,故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
②氯用图2所示装置制取氧气,即加热固体的方法制氧气,可以让氯酸钾在二氧化锰催化下受热分解获得氧气,方程式为:2KClO3MnO2.△2KCl+O2↑,
故答案为:2KClO3MnO2.△2KCl+O2↑;
③为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收,故答案为:使残留在装置中的二氧化硫和三氧化硫被充分吸收;
④装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是mg80g/mol,装置E中产生白色沉淀的质量为ng,则吸收的二氧化硫的物质的量是ng233g/mol,则二氧化硫的转化率=m80m80+m233×100%,故答案为:m80m80+m233×100%;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液汇总出现硫酸根离子,是二氧化硫在酸性环境下和氯水反应生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
③将二氧化硫通入到盛有氢氧化钠的试管c中,所得溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显示中性,所以c(H+)=c(OH-),此时:c(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-).
本题解析:
本题难度:一般
2、选择题 化学与生活、社会密切相关。下列说法正确的是
[? ]
A.用NaOH溶液雕刻工艺玻璃上的纹饰
B.Na2O可用于呼吸面具中作为氧气的来源
C.工业上硝酸可用于制化肥、农药、炸药和染料等
D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
参考答案:C
本题解析:
本题难度:简单
3、选择题 某气体通入品红溶液中,品红溶液褪色,再加热时恢复为原来的颜色,该气体是( )
A.N2
B.SO2
C.CO2
D.H2
参考答案:B
本题解析:
本题难度:简单
4、选择题 将SO2通入BaCl2溶液中未见沉淀产生,若先通入一种气体,再通入SO2可出现白色沉淀,则该气体可能是
[? ]
A.HCl
B.CO2
C.NH3
D.Cl2
参考答案:CD
本题解析:
本题难度:一般
5、选择题 下列物质能使品红溶液褪色的是( )
①盐酸?②过氧化钠?③氯化钠?④二氧化硫?⑤次氯酸钠.
A.①③⑤
B.②④⑤
C.①②④⑤
D.①②③④⑤
参考答案:B
本题解析:
本题难度:简单