时间:2017-03-05 14:26:11
1、填空题 氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知: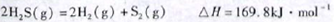
下列有关该反应的叙述正确的是
A.正反应活化能小于169.8kJ·mol-1
B.逆反应活化能一定小于169.8kJ·mol-1
C.正反应活化能不小于169.8kJ·mol-1
D.正反应活化能比逆反应活化能小169.8kJ·mol-1
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是?。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应?(填写字母)。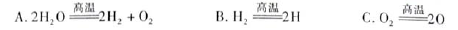
(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是?(写化学式)。
(5)已知下列物质的KSP: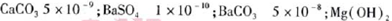
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42—[c(SO42—)>c(Ca2+)]。某精制流程如下: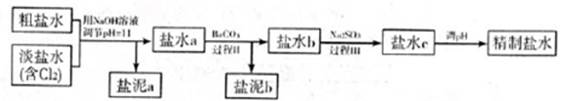
①盐泥a除泥沙外,还含有的物质是?。
②过程I中将NH4+转化为N2的离子方程式是?。
③过程II中除去的离子有?。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液?kg(溶液体积变化忽略不计)
参考答案:(15分,第(1) 1分,其余每空2分)
(1)C ?(2)为H2S热分解反应提供热量?
(3)ABC (只写BC给1分,其它答案不给分)
(4)K2CO3或K2CO3和KOH(只答KOH不给分)
(5)①Mg(OH)2?
②2NH4++3Cl2+8OH-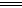 ?N2↑+6Cl-+8H2O
?N2↑+6Cl-+8H2O
③SO42-、Ca2+?④1.26
本题解析:
(1)△H>0说明正反应吸热,正反应活化能大于或等于169.8kJ,C正确;A、B错误;正反应活化能比逆反应活化能大169.8kJ,D错误。
(2)硫化氢分解需吸收热量,通入空气使部分硫化氢燃烧以提供硫化氢分解所需热量。
(3)A、B分别为H、O原子,所以4000℃~5000℃时A、B、C三个反应均能发生。
(4)阴极反应为2H2O+2e-=H2↑+2OH-,阳极产生了氮气,尿素中N为-3价,所以阳极同时生成二氧化碳,二氧化碳与KOH生成碳酸钾。电解排出液中的主要成分是碳酸钾或碳酸钾和氢氧化钾。
(5)①当pH=11时,溶液中c(Mg2+)=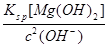 =5.6×10-6<10-5;Mg2+沉淀完全,所以盐泥a中含有氢氧化镁。②氯气碱性条件下将NH4+氧化生成N2,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。③BaCO3(s)
=5.6×10-6<10-5;Mg2+沉淀完全,所以盐泥a中含有氢氧化镁。②氯气碱性条件下将NH4+氧化生成N2,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。③BaCO3(s)  Ba2+(aq)+CO32-(aq),SO42-与Ba2+、CO32-与Ca2+形成更难溶的硫酸钡和碳酸钙,所以过程II加入碳酸钡除去Ca2+和SO42-。④过程III加入亚硫酸钠溶液还原溶液的ClO-,由得失电子相等得n(ClO-)=n(SO32-),
Ba2+(aq)+CO32-(aq),SO42-与Ba2+、CO32-与Ca2+形成更难溶的硫酸钡和碳酸钙,所以过程II加入碳酸钡除去Ca2+和SO42-。④过程III加入亚硫酸钠溶液还原溶液的ClO-,由得失电子相等得n(ClO-)=n(SO32-),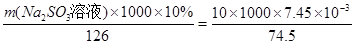 ,m(Na2SO3溶液)=1.26kg。
,m(Na2SO3溶液)=1.26kg。
本题难度:困难
2、选择题 下列说法正确的是(?)
A.原子间的相互作用叫做化学键
B.阴、阳离子间通过静电吸引形成的化学键是离子键
C.AlCl3中含有共价键,NH4Cl属于离子化合物
D.物质中都含有化学键
参考答案:C
本题解析:A、使离子相结合或原子相结合的作用力通称为化学键,故错;B、阴、阳离子间通过静电作用形成的化学键是离子键,故错;D、稀有气体分子中不含化学键,故错。故选C。
点评:本题考查的是化学键的相关知识,题目难度不大,熟悉化学键的构成原理是解题的关键。
本题难度:一般
3、选择题 下列热化学方程式书写正确的是
A.2SO2+O2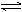 2SO3; △H=-196.6kJ/mol
2SO3; △H=-196.6kJ/mol
B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol
C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ
参考答案:C
本题解析:略
本题难度:一般
4、填空题 两个硫酸分子可以脱去1分子水生成焦硫酸(H2S2O7),已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是______.
参考答案:硫酸的分子中有4个硫氧键,两个硫酸分子可以脱去1分子水生成焦硫酸(H2S2O7),焦硫酸的结构式为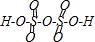 ,根据其结构式知,焦硫酸中含有硫氧键个数是8,故答案为:8.
,根据其结构式知,焦硫酸中含有硫氧键个数是8,故答案为:8.
本题解析:
本题难度:一般
5、选择题 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是: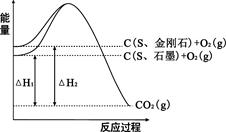
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
参考答案:B
本题解析:A、物质的能量越低越稳定,根据图中曲线可知,石墨的能量低于金刚石,所以石墨比金刚石稳定,错误;B、石墨转化为金刚石吸热,所以?H=395.0kJ?mol?1-393.5kJ?mol?1=+1.5kJ?mol?1,正确;C、根据图中曲线可知△H1的绝对值<△H2的绝对值,因为燃烧为放热反应,?H<0,所以△H1>△H2,错误;D、使用催化剂不影响?H,错误。
本题难度:一般