时间:2017-03-05 14:22:54
1、选择题 已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ/mol、285.8kJ/mol和870.3kJ/mol,(注:CH3COOH的燃烧产物是CO2和H2O)则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )
A.-488.3KJ?mol-1
B.-762.6kJ?mol-1
C.-654.9kJ?mol-1
D.+191kJ?mol-1
2、填空题 已知下列两个反应:
a.C2H2(g)+H2(g)=C2H4(g) ΔH<0
b.2CH4(g)=C2H4(g)+2H2(g) ΔH>0
判断以下3个热化学方程式ΔH1、ΔH2、ΔH3由大到小的顺序是__________________________________。 ①C(s)+2H2(g)=CH4(g) ΔH1
②C(s)+1/2H2(g)=1/2C2H2(g) ΔH2
③C(s)+H2(g)=1/2C2H4(g) ΔH3
3、简答题 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1
②C(石墨)+CO2(g)=2CO(g)△H2,则△H=______(用含△H1、△H2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=______.
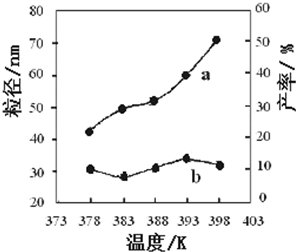
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 甲/mol 1.0 1.0 1.0 1.0 乙/mol 1.0 1.5 1.0 1.0 |
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 ① 378 3 3:1 | 实验②和④探究______ 实验②和______探究反应时间对产率的影响 ② 378 4 4:1 ③ 378 3 ______ ④ 398 4 4:1 |
4、填空题 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以_______?的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为____0(填“大于”.“小于”),该反应是?_____(填“放热”或“吸热”)反应。?
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。?
已知:298K时,
H2(g)+Cl2(g)=2HCl(g)?ΔH=?-185?kJ/mol?ΔH(H2)=?436?kJ/mol, ΔH(Cl2)=?247?kJ/mol。?则ΔH(HCl)=?________________。
(3)Hess?G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)?ΔH?=?-25?kJ/mol?
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)?ΔH?=?-47?kJ/mol?
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)?ΔH?=?+19?kJ/mol
请写出CO还原FeO的热化学方程式_______________________。?
5、选择题 如下图所示,△H1=-393.5 kJ/mol,△H2=-395.4 kJ/mol,下列说法或表示式正确的是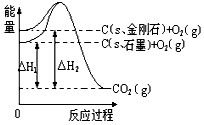
[? ]
A.C(s、石墨)== C(s、金刚石) △H=+1.9 kJ/mol
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ