时间:2017-03-05 14:19:54
1、填空题 将酚酞滴入Ba(OH)2的稀溶液,溶液显红色;①通入SO2后红色褪去,并有白色沉淀产生;② 继续通过量SO2,沉淀消失;③再加少量NaOH溶液,沉淀重新出现;④加盐酸后沉淀又消失。 根据上述实验现象,写出相应反应的离子方程式:
(1)____________________________。
(2)____________________________。
(3)____________________________。
(4)____________________________。
参考答案:(1) Ba2++2OH-+SO2 = BaSO3↓+2H2O
(2) SO2+BaSO3+H2O =Ba2++2HSO3-
(3) Ba2++HSO3-+OH- = BaSO3↓+H2O
(4) BaSO3+2H+ = Ba2++H2O+SO2↑
本题解析:
本题难度:一般
2、选择题 SO2气体分别通入下列溶液中,气体不反应是
[? ]
A.NaOH溶液
B.酸性KMnO4
C.溴水
D.CuSO4溶液
参考答案:D
本题解析:
本题难度:简单
3、选择题 天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示: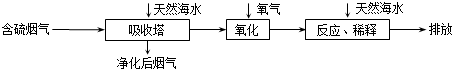
下列说法错误的是( )
A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
参考答案:A.海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确;
B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C正确;
D.从框图可知:排放”出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42-的物质的量浓度排放出来的海水中浓度小,故D错误;
故选D.
本题解析:
本题难度:简单
4、选择题 除去二氧化硫中三氧化硫不可采用的方法是( )
A.通过冰水混合物冷却
B.通过98.3%的浓硫酸
C.通过饱和的Na2SO3溶液
D.通过饱和的NaHSO3溶液
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列溶液中通入SO2一定不会产生沉淀的是
[? ]
参考答案:D
本题解析:
本题难度:简单