时间:2017-03-05 14:12:38
1、实验题 (12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是: ;
(4)如下图是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol·L-1
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
2、选择题 下列溶液一定呈碱性的是( ? )
A.pH=8的溶液
B.含有OH-离子的溶液
C.NaCl溶液
D.c(OH-)>c(H+)的溶液
3、选择题 下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2 + 2KI =" 2KBr" + I2说明Br的非金属性强于I
④常温时,0.1 mol·L-1 盐酸中由水电离出的c(H+)<10-7mol·L-1
A.①②
B.③④
C.①③
D.②④
4、选择题 下列溶液一定呈酸性的是
A.pH<7的溶液
B.c(H+)>c(OH—) 的溶液
C.pH>7的溶液
D.c(H+)<c(OH—) 的溶液
5、选择题 25℃时,水的电离达到平衡: 。下列叙述正确的是
。下列叙述正确的是
[? ]
A.向水中加入稀氨水,平衡逆向移动,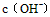 降低
降低
B.向水中加入少量固体硫酸氢钠, 增大,Kw不变
增大,Kw不变
C.向水中加入少量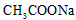 固体,平衡逆向移动,
固体,平衡逆向移动,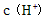 降低
降低
D.将水加热,Kw增大,pH不变