时间:2017-03-05 14:02:10
1、填空题 人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式: 。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
参考答案:(16分)
(1) Pb+SO42-
本题解析:
本题难度:一般
2、选择题 关于如图所示装置的叙述,对其描述正确的是( )
A.铜是负极,铜片上有气泡产生
B.该装置将电能转变为化学能
C.电子流从锌片经导线流向铜片
D.氢离子在锌片表面被还原
参考答案:A、锌片、铜片和稀硫酸溶液构成的原电池中,铜作正极,正极上氢离子得电子生成氢气,故A错误;
B、原电池是将化学能转变为电能的装置,故B错误;
C、锌失电子通过导线流向铜,所以电子流向为由Zn经导线流入Cu片,即从负极通过导线流向正极,故C正确;
D、铜作正极,正极上氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑,故D错误.
故选C.
本题解析:
本题难度:简单
3、填空题 如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_______________________________;
②乙中总反应的离子方程式为____________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了I-生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为_____________________________;
②如果起始时乙中盛有200?mL?pH=5的CuSO4溶液(25?℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入__________(填写物质的化学式)________g。
参考答案:(1)①O2+2H2O+4e-===4OH-;②2Cl-+2H2O 2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O===10HCl+2HIO3
2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe-2e-=Fe2+;②CuO(或CuCO3);0.8(或1.24)
本题解析:
本题难度:一般
4、选择题 某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不正确的是
A.镁为负极
B.原电池中碳极的电极反应式为Fe3++e-=Fe2+
C.电解池中阳极处先变红
D.电解池中阴极的电极反应式为2H++2e-=H2↑
参考答案:C
本题解析:据图可知,左池为原电池,镁活泼作负极,C为正极,电极反应为Fe3++e-=Fe2+;右池为电解池,与Mg相连的电极为阴极,电极反应式为2H++2e-=H2↑,与C相连的电极为阳极,电极反应为:2I--2e-=I2,故可使淀粉变蓝。故C错误。
本题难度:一般
5、填空题 设计新型燃料电池是本世纪最富有挑战性的课题之一。
(1)有人制造了一种燃料电池,一个电极通入O2(含有少量CO2),另一个电极通入CH4,电池的电解质是熔融的K2CO3。该电池的负极反应式为____________________________,电池工作时,电解质里的CO(向________极移动(填“正”或“负”)。
(2)某科研小组依据甲醇燃烧的反应原理,设计如图10-3所示的原电池装置。该电池的负极反应式为________________________________________________,用该电池电解CuCl2溶液,当产生33.6 L Cl2(标准状况下)时,消耗甲醇的质量为________g。
参考答案:(1)CH4+4CO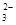 -8e-===5CO2+2H2O 负
-8e-===5CO2+2H2O 负
(2)CH3OH+8OH--6e-===CO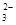 +6H2O 16
+6H2O 16
本题解析:(1)CH4在负极放电,生成CO2和H2O,电极反应式为CH4+4CO-8e-===5CO2+2H2O;熔融电解质中的阴离子向负极移动。
(2)该燃料电池的总反应方程式为:2CH3OH+3O2+4OH-===2CO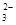 ?+6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO
?+6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO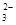 +6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)=
+6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)=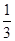 ?n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。
?n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。
本题难度:一般