时间:2017-03-05 14:01:30
1、填空题 下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
① ⑩ ② ③ ④ ⑤ ⑦ ⑧ ⑨ ⑥ | |||||||||||||||||||||||||||
参考答案:根据元素在周期表中的分布可以知道①是C,②是O,③是F,④Mg,⑤是Al,⑥是Se,⑦是S,⑧是Cl,⑨是Ar,⑩是N.
(1)同周期元素原子半径从左到右逐渐减小,同主族元素从上到下原子半径逐渐增大,所以半径最小的在左上角,应该是F,稀有气体Ar的化学性质稳定,14C可测定文物年代,故答案为:F;Ar;可测定文物年代;
(2)元素C的原子结构示意图为: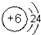
,最高价氧化物二氧化碳是含有碳氧双键的非极性分子,
结构式为:O=C=O,氮气是含有氮氮三键的物质,单质电子式为:
,氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物,用电子式表示其的形成过程为: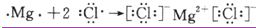
,
故答案为: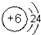
;
;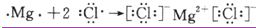
;
(3)元素Al的氧化物氧化铝与盐酸反应的离子方程式为:Al2O3 +6H+=2Al3++3H2O,金属铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al2O3 +6H+=2Al3++3H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)金属铝、铁和硫酸构成的原电池中,活泼金属铝做负极,发生失电子的氧化反应,根据原电池的构成条件,画出电池装置为: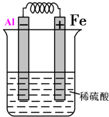
,电极反应为:Al-3e-=Al3+,
故答案为:
;Al-3e-=Al3+;
(5)氯气能溶于水,形成的水溶液是浅黄绿色的,氯气具有氧化性,能氧化二氧化硫,
反应的方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:浅黄绿色;SO2+Cl2+2H2O=H2SO4+2HCl;
(6)S元素的最高正价=最外层电子数=6,|最低负价|+最高正价=8,所以最低负价是-2价,S元素与H2反应有一定限度,同主族元素从上到下元素单质和氢气化合是越来越难,所以在相同条件下元素Se与H2反应的限度更小,故答案为:+6;-2;更小.
本题解析:
本题难度:一般
2、选择题 A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含?量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
[? ]
A.最高价氧化物对应水化物的碱性:C?<?D?
B.气态氢化物的稳定性:A>B
C.四种元素能够在同一周期?
D.原子半径:C>A
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列各组化合物性质的比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.非金属性:F>O>S
D.稳定性:PH3>H2S>HCl
参考答案:A.非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>HBrO4>HIO4,故A正确;
B.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C.同周期元素从左到右元素的非金属性逐渐增强,则非金属性:F>O,同主族元素从上到下元素的非金属性逐渐减弱,则非金属性:O>S,则有非金属性:F>O>S,故C正确;
D.非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,则稳定性:PH3<H2S<HCl,故D错误.
故选D.
本题解析:
本题难度:简单
4、推断题 一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为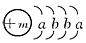 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A.XY2的电子式: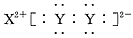
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为: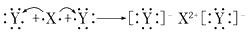
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________。
参考答案:(1)20;CaCl2
(2)硫;碳
(3)B
(4)BD
(5)水分子间存在氢键
本题解析:
本题难度:一般
5、选择题 已知1~18号元素的离子,aW3+,bX-,cY2-,dZ-都具有相同的电子层结构,下列关系正确的是
[? ]
A.质子数:c>b
B.离子的还原性:Y2->Z
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:B
本题解析:
本题难度:一般