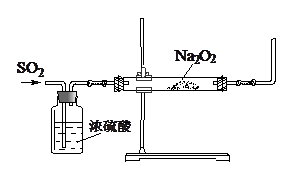?
参考答案:(16分)
(1)缺少了尾气吸收装置。
(2)2SO2+2Na2O2=2Na2SO3+O2↑
(3)Na2O2具有强氧化性,会将SO2氧化
(4)全部为Na2SO4
实验步骤
预期现象和结论
步骤1:
?
步骤2:向A试管中滴加1~2滴0.01 mol·L-1 KMnO4溶液。
如果KMnO4溶液不褪色,则假设Ⅲ成立。
如果KMnO4溶液褪色,则假设1或2成立;
步骤3:向B试管中加入足量1 mol·L-1盐酸,再滴加1~2滴0.1mol·L-1BaCl2溶液
如果不出现白色沉淀则假设Ⅰ成立。
如果出现白色沉淀,且步骤2中KMnO4溶液褪色,则假设Ⅱ成立。
本题解析:略
本题难度:一般
2、选择题 下列化学实验能达到目的的是
A.用激光笔检验某KI溶液中是否溶有淀粉
B.加入适量溴水后过滤,可除去苯中的少量苯酚
C.向碘水中加入苯或酒精,均可从碘水中萃取碘
D.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)
参考答案:A
本题解析:略
本题难度:一般
3、实验题 (10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑ CuO + SO3↑
2SO3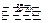 2 2 SO2↑+ O2↑ SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。
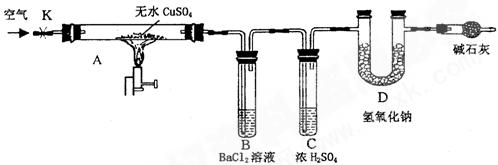
实验步骤:
①称量反应前D 管的质量。 管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。 。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。
参考答案:(1)有气泡冒出,产生白色沉淀,且明显放热(2分)
SO3 + H2O + Ba2+= BaSO4↓+ 2H+
或SO3 + H2O = 2H++SO42-, SO42- + Ba2+= BaSO4↓(4分)
(2) SO3溶于水放热(2分)
(3)不能(2分),SO3不能完全分解为SO2和O2, 且部分SO2会溶解在溶液中(4分)
本题解析:略
本题难度:简单
4、实验题 某同学根据题目提示和要求选择下列仪器设计实验,验证:
Zn+2H2SO4 (浓)  ZnSO4+SO2↑+2H2O; ZnSO4+SO2↑+2H2O;
Zn+H2SO4(稀)==ZnSO4+H2↑ 提示和要求:
①供选用的试剂有:98%浓硫酸,锌粒,氧化铜,碱石灰,无水硫酸铜,溴水,品红试液,碱石灰,
②二氧化硫具有还原性,可能与金属氧化物发生还原反应;
③E和F仪器同时使用;
④仪器可以重复使用.
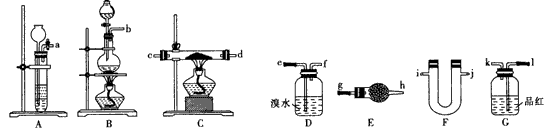
(1)组合装置(气流从左至右)的接口连接顺序:____。
(2)D装置发生反应的离子方程式:_______;C装置发生反应的化学方程式: ___________。
(3)E装置中药品是碱石灰,F装置应装入_________,其作用是________。
(4)证明锌与浓硫酸反应有二氧化硫产生的现象是_________;锌与稀硫酸反应产生氢气的现象是____________。
(5)简述锌与浓硫酸反应开始不产生氢气的原因________。
参考答案:(l)b→1-k→e-f→1-k→g-h→cd(dc)→ij(ji)?
(2)SO2+2H2O+Br2==SO42-+2Br-+4H+; CuO+H2 Cu+H2O Cu+H2O
(3)无水硫酸铜;检验产物水
(4)气体开始通人品红溶液时,品红褪色;C中黑色粉末变红色,F中无水硫酸铜由白色变成蓝色
(5)浓硫酸中主要以H2SO4形式存在,H+很少;且+6价硫的氧化性强于H的氧化性
本题解析:
本题难度:一般
5、实验题 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:___________________________。
(2)若实验室只有浓硫酸、浓盐酸、浓氨水、氢氧化钠固体、氯化铵固体、氧化钙、无水氯化钙、石蕊试液和如图1所示气体发生装置,你认为他们能制得所需的气体吗?把你的判断填入下表
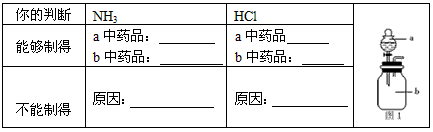
收集氯化氢气体应使用______________法,要得到干燥的氨气可选用______________作干燥剂。
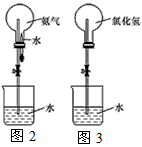
(3)如果用图2装置进行喷泉实验,上部烧瓶已装满干燥氨气,打开止水夹,挤出胶头滴管中的水引发水上喷。该实验的原理是________________________。
(4)如果用图3装置进行喷泉实验,上部烧瓶已装满干燥氯化氢气体,请说明引发喷泉的方法。______________________________。
(5)若至喷泉实验停止图,图2中剩有烧瓶容积1/5的气体;图3烧瓶中剩有烧瓶容积1/4的气体;则图3烧瓶中盐酸的物质的量浓度为____________(两种气体均在标准状况下收集);图2烧瓶中氨水的物质的量浓度___________(填“大于”、“小于”、“等于”)图3烧瓶中盐酸的物质的量浓度。
(6)若取上述两种溶液等体积混合,溶液中离子浓度由大到小的顺序为______________若使上述两种溶液混合后,溶液中NH4+离子浓度等于Cl-离子浓度应如何操作:_________________________________。
参考答案:(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O(2) 2NH3↑+CaCl2+2H2O(2) 向上排空气;氢氧化钠固体或氧化钙 向上排空气;氢氧化钠固体或氧化钙
(3)氨气极易溶解于水,致使烧瓶内气体压强迅速减小
(4)打开夹子,用手(或热毛巾)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉(答案合理即可)
(5)1/22.4mol/L(或0.45mol/L);等于
(6)c(Cl-)>c(NH4+)>c(H+)>c(OH-);向混合液中滴加氨水至溶液pH=7
本题解析:
本题难度:困难
|