时间:2017-03-05 13:52:17
1、选择题 下列说法正确的是
[? ]
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
2、选择题 下列性质适合于分子晶体的是
[? ]
A.熔点1070℃,易溶于水,水溶液导电
B.熔点10.31 ℃,液态不导电.水溶液能导电
C.能溶于CS2熔点112.8 ℃,沸点444.6℃
D.熔点97.81℃,质软.导电.密度0.97 g/cm3
3、选择题 1995年美国Lagow教授报道,他制得了碳的第四种同素异形体-链式炔碳: …-C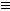 C-C
C-C C-C
C-C C-…,该物质的一个分子中含有300~500个碳原子,性质很活泼。下列关于该链式炔碳的熔点判断正确的是
C-…,该物质的一个分子中含有300~500个碳原子,性质很活泼。下列关于该链式炔碳的熔点判断正确的是
[? ]
A.比石墨高
B.比石墨低
C.低于石墨而高于金刚石
D.无法判断
4、选择题 下列各组物质各自形成的晶体,均属于分子晶体的化合物是
[? ]
A.NH3、HD、C10H8
B.PCl3、CO2、CH3COONH4
C.NO、SiO2、P2O5
D.H2O2、CF2Cl2、B3N3H6
5、选择题 下列关系不正确的是
[? ]
A.离子半径:Cl-> F->Na+>Al3+
B.熔点:石英>食盐>冰>干冰
C.碳酸盐的分解温度:MgCO3>CaCO3>BaCO3
D.热稳定性:HF>HCI>H2S>PH3