时间:2017-03-05 13:42:24
1、选择题 下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是( )
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
2、选择题 下列反应属于氧化还原反应的是
A.CaCO3=CaO+CO2↑
B.SO2+H2O=H2SO3
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O
D.CH4+2O2=CO2+2H2O
3、选择题 以下说法正确的是( )
A.不能自发进行的反应属于吸热反应
B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应
C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能
4、选择题 能在水溶液中大量共存的一组离子是
A.Na+、Mg2+、I-、ClO-
B.Al3+、NH、SO、Cl-
C.K+、Ag+、NO、Cl-
D.NH、Na+、OH-、SiO
5、填空题 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: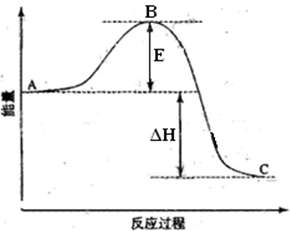
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)图中△H= KJ·mol-1。