时间:2017-03-05 13:38:09
1、填空题 工业上制备 BaC12 的工艺流程图如图所示: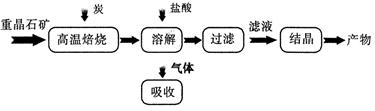
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得: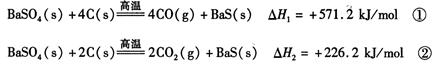
(1)反应C(s) + CO2(g) 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol
(2)过滤过程中需要使用玻璃棒,玻璃棒的作用是 。
(3)盐酸溶解焙烧的固体后,产生的气体用过量 NaOH 溶液吸收,得到硫化钠溶液。 Na2S 水解的离子方程式为 。
(4)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,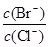 = 。[已知:
= 。[已知:
Ksp(AgBr) = 5.4×10─13 , Ksp(AgCl) = 2.0×10─10]
参考答案:(1)+172.5 (2)引流 (3)S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-;(4)2.7×10-3.
H2S+OH-;(4)2.7×10-3.
本题解析:利用盖斯定律将方程式(①-②)/2得C(s) + CO2(g) 2CO(g)的△H ="+172.5" kJ/mol;向
2CO(g)的△H ="+172.5" kJ/mol;向
BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,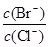 为AgCl与AgBr的溶度积的比值。
为AgCl与AgBr的溶度积的比值。
考点:热化学方程式的计算、盐类的水解、难溶电解质的溶度积。
本题难度:一般
2、选择题 Al3+ + 3H2O Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
A.加热
B.加适量NaOH溶液
C.通入氯化氢气体
D.加入固体三氯化铝
参考答案:B
本题解析:水解吸热,加热促进水解,溶液的pH降低,A不正确;氢氧化钠能结合氢离子,降低氢离子的浓度,常见水解,B正确;C中增大氢离子的浓度,抑制水解,不正确;D中氧化铝不溶于水,对水解平衡几乎没有影响,不正确,答案选B。
考点:考查外界条件对水解平衡的影响
点评:该题是中等难度试题的考查,也是高考中的常见题型和考点。该题的关键是明确氯化铝的水解平衡特点,然后结合题意灵活运用勒夏特列原理即可,难度不大。
本题难度:一般
3、填空题 (每小题4分,共12分)
(1)氨水和稀盐酸反应后的溶液呈中性,反应后所得溶液中的离子浓度大小关系是__ _。
(2)Na2CO3溶液中,其离子浓度从大到小关系为 。
(3)有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.则原混合溶液中Ba(OH)2的物质的量浓度 。
参考答案:(1)c(NH4+)=c(Cl-) >c(OH-)=c(H+) ;(2) C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
(3)0.025mol/L
本题解析:(1)氨水和稀盐酸溶液呈中性,c(OH-)=c(H+) 溶液中含有铵根离子、氯离子、氢氧根离子和氢离子,故离子浓度为c(NH4+)=c(Cl-) >c(OH-)=c(H+);(2)碳酸钠为强碱弱酸盐,水解呈碱性,以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);(3)发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O、2NaOH+H2SO4=Na2SO4+2H2O,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半,说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的,所以Ba(OH)2、NaOH的物质的量浓度比为1:2,因为pH=13,所以原溶液中2c[Ba(OH)2]+c(NaOH)=0.1mol/L,故2c[Ba(OH)2]+2c[Ba(OH)2]=0.1mol/L,解得c[Ba(OH)2]=0.025mol/L,答案为0.025mol/L
考点:化学方程式的有关计算
本题难度:一般
4、选择题 下列反应中,属于水解反应且使溶液显酸性的是( )
A.HSO3-+H2O═H3O++SO32-
B.HCO3-+H3O+═CO2↑+2H2O
C.S2-+H2O═HS-+OH-
D.NH4++H2O═NH3?H2O+H+
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列说法不正确的是
A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-)
B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-)
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡
D.常温常压下能自发进行的反应,一定都是放热反应
参考答案:D
本题解析:硫酸铵化学式为(NH4)2SO4,属于强酸弱碱盐,水溶液呈酸性,所以A正确;根据电荷守恒原理可知,溶液中阴离子带的负电 荷总数应该等于阳离子带的正电荷,故B正确;Na2CO3属于强碱弱酸盐,水溶液呈碱性,所以滴有酚酞的溶液变红,当加入氯化钡溶液后,生成碳酸钡沉淀和氯化钠溶液,呈中性,故C正确;能否自发进行,除了和焓变有关,与熵变也有关,它们共同决定,故D错误。
考点:考查电离平衡相关知识
本题难度:一般