时间:2017-03-05 13:38:09
1、填空题 (6分)常温下,已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合后,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”)
(2)0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中,
c(IO3-) c(Na+)(填“大于”、“小于”或“等于”)。
(3)已知某溶液中只存在OH-、H+、IO4-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Na+)>c(IO4-)>c(OH-)>c(H+)
B.c(IO4-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(OH-)>c(IO4-)>c(H+)
D.c(IO4-)>c(Na+)>c(H+)>c(OH-)
填写下列空白:
①若溶液中只有一种溶质,则该溶质是 ,上述四种离子浓度大小顺序为________(填选项的标号)
②若上述关系中C项是正确的,则溶液中的溶质有 、
2、选择题 下列能正确表示水解的离子方程式是
[? ]
A.CH3COOH + H2O CH3COO- + H3O+
CH3COO- + H3O+
B.Br- + H2O HBr + OH-
HBr + OH-
C.CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NH4+ + H2O NH3·H2O + H+
NH3·H2O + H+
3、填空题 氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
4、填空题 (12分)完成下列各题:
(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);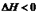 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 ;
②可以判断上述反应在体积不变的密闭容器中,反应达到平衡的是 。
A.平均相对分子质量不变 B.V正(N2)=2V逆(NH3)
C.密闭容器中总压强不变 D.N2与H2的物质的量之比为1:3
E.反应物不再转化为生成物
③在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为 ;(填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol D.不能确定
④下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线。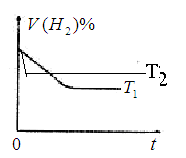
(2)已知:Al3 +与HCO3
5、选择题 在盐类的水解过程中,下列叙述正确的是
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.没有中和反应发生
D.溶液的pH一定变大