时间:2017-03-05 13:36:51
1、选择题 设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3 ===2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
参考答案:D
本题解析:A.0.2mol铁与水蒸气完全反应生成四氧化三铁,失去电子的物质的量为:(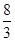 -0)×0.2mol=
-0)×0.2mol=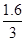 mol,根据电子守恒,生成氢气的物质的量为:
mol,根据电子守恒,生成氢气的物质的量为: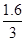 mol÷2=
mol÷2=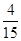 mol,生成的H2分子数目为
mol,生成的H2分子数目为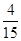 NA,故A错误;B.在溶液中氯化氢完全电离,不存在氯化氢分子,故B错误;C.氢氧燃料电池中,正极氧气得到电子,标况下22.4L氧气的物质的量为1mol,1mol氧气完全反应得到4mol电子,电路中通过的电子数目为4NA,故C错误;D.该氧化还原反应中,生成4mol氮气转移了15mol电子,28g氮气的物质的量为1mol,生成1mol氮气转移的电子的物质的量为:15mol÷4=3.75mol,转移的电子数目为3.75NA,故D正确;故选D。
NA,故A错误;B.在溶液中氯化氢完全电离,不存在氯化氢分子,故B错误;C.氢氧燃料电池中,正极氧气得到电子,标况下22.4L氧气的物质的量为1mol,1mol氧气完全反应得到4mol电子,电路中通过的电子数目为4NA,故C错误;D.该氧化还原反应中,生成4mol氮气转移了15mol电子,28g氮气的物质的量为1mol,生成1mol氮气转移的电子的物质的量为:15mol÷4=3.75mol,转移的电子数目为3.75NA,故D正确;故选D。
考点:考查阿伏加德罗常数的有关计算和判断
本题难度:一般
2、填空题 (12分)粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。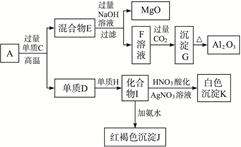 ?
?
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________。
(3)写出由F生成G的离子方程式:________。
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05? mol,则B的化学式为_________。
(5)若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A,恰好与含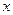 mol HCl的盐酸完全反应,则
mol HCl的盐酸完全反应,则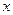 的取值范围是___________(保留小数点后两位)。
的取值范围是___________(保留小数点后两位)。
参考答案:(1)Al Cl2
(2)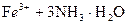 ====
====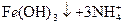
(3)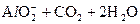 ====
====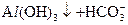
(4)FeO
(5)0.26<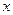 <0.40(若是0.27<
<0.40(若是0.27<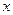 <0.40,不扣分)
<0.40,不扣分)
本题解析:根据上述转化关系可知单质D为铁单质,原固体中含有铁的氧化物,对应的单质C为铝单质。
本题难度:简单
3、选择题 在用浓盐酸配制1.0mol/L HCl溶液的实验中,不需要使用的仪器是
[? ]
A.托盘天平
B.烧杯
C.玻璃棒
D.胶头滴管
参考答案:A
本题解析:
本题难度:简单
4、选择题 标准状况下,将11.2 L O2、11 g CO2、0.25 mol N2混合,则该混合气体的体积为(?)
A.2.24L
B.22.4 L
C.44.8 L
D.24.5 L
参考答案:B
本题解析: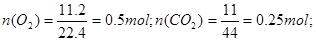 则混合气体中总物质的量为
则混合气体中总物质的量为
0.5mol+0.25mol+0.25mol=1mol,即正确答案为B,
本题难度:简单
5、选择题 如果1g水中含有n个氢原子,则阿伏加德罗常数是?(?)
A.n/1mol-1?B.9n mol-1?C.2nmol-1?D.nmol-1
参考答案:B
本题解析:略
本题难度:简单