时间:2017-03-05 13:33:13
1、选择题 4.6 g金属钠与水反应后所得溶液中,要使100个水分子溶有1个钠离子,需要水的质量是(? )
A.180 g
B.181.8 g
C.360 g
D.363.6 g
参考答案:D
每个人都是靠自己的本事而受人尊重的。——伊索
本题解析:钠与水反应生成钠离子,需消耗一部分水,然后再根据粒子个数比等于其物质的量之比,求出所生成的钠离子需结合水的物质的量。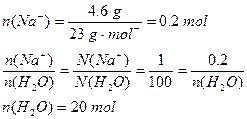
2Na? +? 2H2O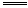 2NaOH+H2
2NaOH+H2
2? 2
0.2mol? 0.2 mol
(20+0.2)mol×18 g·mol ="363.6" g
="363.6" g
本题难度:简单
2、选择题 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为(? )
A.+1? B.+2 ? C.+3?D.+4
参考答案:A
本题解析:根据题意分析得,VB=2VC,VA=VB+VC=3 VC,等物质的量的主族金属A、B、C与稀盐酸反应,C生成的氢气最小,即C的化合最小,从而可得C在生成物中化合价为+1价。
本题难度:一般
3、选择题 阿伏加德罗常数约为6.02×1023 mol-1,下列说法中一定正确的是(?)
A.3.4gNH3含共价键的数目约为0.2×6.02×1023个
B.l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32-
C.标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子
D.6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子
参考答案:D
本题解析:A:3.4gNH3含共价键的数目约为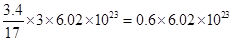 个;B:碳酸钠溶液中的CO32-部分水解;C:2SO2+O2
个;B:碳酸钠溶液中的CO32-部分水解;C:2SO2+O2 2SO3,可逆反应不可能全部进行到底;D:每个铜失去两个电子,所以6.4g Cu充分反应后推动的电子数必为0.2×6.02×1023个,答案为D
2SO3,可逆反应不可能全部进行到底;D:每个铜失去两个电子,所以6.4g Cu充分反应后推动的电子数必为0.2×6.02×1023个,答案为D
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列说法中正确的是?(?)
A.1mol Na2SO4溶于水中,所得溶液中Na+个数为NA
B.54g H2O中含有3NA个水分子
C.标准状况下, NA个水分子所占的体积为22.4L
D.1mol 氢中所含的原子数为NA
参考答案:B
本题解析:
A、不正确,1mol Na2SO4溶于水中,所得溶液中Na+个数为2NA
B、正确,54g H2O是3mol,含有3NA个水分子
C、不正确,标准状况下,水是液体;
D、不正确,1mol 氢气中所含的原子数为2NA ;
选B。
本题难度:一般
5、简答题 实验室配制500ml2mol?L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、______、______.
(2)容量瓶在使用前,首先应检查______.
(3)此实验中,玻璃棒的两个作用分别是______、______.
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸______ml.
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水______(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响______.(填“有影响”或“无影响”)
参考答案:(1)实验室配制500ml 2mol?L-1的H2SO4溶液,配制顺序是:计算→量取→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,需要的仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:胶头滴管; 烧杯.
(2)容量瓶有瓶塞,容量瓶在使用前,首先应检查容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(3)在稀释浓硫酸时,使用玻璃棒进行搅拌,加速溶解过程;在转移溶液时,使用玻璃棒进行引流,避免液体流到容量瓶以外,
故答案为:搅拌; 引流;
(4)密度为1.84g/cm3,质量分数为98%的浓硫酸浓度为:1000×1.84×98%98mol/L=18.4mol/L,
500ml 2mol?L-1的H2SO4溶液中需要硫酸的物质的量为:2mol?L-1×0.5L=1mol,需要浓硫酸的体积为:1mol18.4mol/L=0.0543L=54.3mL,
故答案为:54.3ml;
(5)配好摇匀后,发现容量瓶中的液面略低于刻度线,由于刻度线上面含有部分溶液没有流下来,不需要加入蒸馏水;若配制前容量瓶中有蒸馏水,由于定容时需要加入蒸馏水,所以不影响配制结果,
故答案为:不应该; 无影响.
本题解析:
本题难度:一般