时间:2017-03-05 13:32:34
1、填空题 有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
参考答案:
(1)0.1 mol (2) 0.1 mol(3)0.1 mol/L(4)增加 (5)Zn + Cu2+ = Zn2+ + Cu
本题解析:锌片插入足量CuSO4溶液发生反应为:Zn+CuSO4=ZnSO4+Cu。锌是还原剂,CuSO4是氧化剂,ZnSO4还原产物,Cu是还原产物。根据方程式可得每有1mol锌即65克参加反应就生成64克铜,对固体来说质量减少;对溶液来说质量增加。这时固体质量减少1克,现在质量减少0.1克,所以参加反应的还原剂锌的物质的量是0.1摩尔,C(ZnSO4)=0.1mol/1L=0.1 mol/L.该反应的离子方程式是:)Zn + Cu2+ = Zn2+ + Cu。
考点:考查离子反应方程式的书写及氧化还原反应的有关概念及相应的化学计算等的知识。
本题难度:一般
2、选择题 下列有关0.2 mol·L-1 BaCl2溶液的说法中,不正确的是(? )
A.500 mL溶液中Cl-浓度为0.2 mol·L-1
B.500 mL溶液中Ba2+浓度为0.2 mol·L-1
C.500 mL溶液中Cl-总数为0.2 NA
D.500 mL溶液中Ba2+和Cl-总数为0.3NA
参考答案:A
本题解析:离子的浓度大小与溶液的体积无关,只与电解质的浓度有关。离子的浓度等于电解质的浓度与电解质化学式中该离子个数的乘积。离子的数目等于离子的浓度与溶液的体积得到乘积的NA倍。A. Cl-浓度为0.4 mol·L-1 .错误。B. Ba2+浓度为0.2 mol·L-1。正确。C.500 mL溶液中Cl-总数为0.4mol/L×0. 5L×NA="0.2" NA.正确。D.500 mL溶液中Ba2+和Cl-总数为:(0.2 mol·L-1×0. 5L +0.4mol/L×0. 5L)×NA =0.3NA正确。
本题难度:一般
3、选择题 8.NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA
B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
C.6.8克熔融的KHSO4混中含有0.1NA个阳离子
D.标准状况下,11.2L四氯化碳所含分子数为0.5NA
参考答案:B
本题解析:A项红热的铁与水蒸气可发生反应:3Fe+4H2O(g)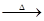 Fe3O4+4H2,铁过量水蒸气不足,所以1mol水蒸气充分反应转移的电子数为2NA;6.8克即0.05mol熔融的KHSO4电离产生K+和HSO4-,因而含有0.05NA个阳离子;标准状况下,CCl4为液态,不能带人进行计算。
Fe3O4+4H2,铁过量水蒸气不足,所以1mol水蒸气充分反应转移的电子数为2NA;6.8克即0.05mol熔融的KHSO4电离产生K+和HSO4-,因而含有0.05NA个阳离子;标准状况下,CCl4为液态,不能带人进行计算。
考点:阿伏加德罗常数
点评:本题考查了阿伏加德罗常数的有关计算,难度不大,但要注意条件。
本题难度:一般
4、选择题 下列叙述正确的是
A.常温常压下,4.6 g NO2气体约含有1.81×1023个原子
B.在标准状况下,80 gSO3所占的体积约为22.4L
C.常温下,0.1 mol/L醋酸溶液的pH约为1
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA
参考答案:A
本题解析:A.常温常压下,4.6 g NO2气的物质的量是0.1mol,所以约约含有1.81×1023个原子,正确;B.在标准状况下, SO3是固体,不能使用气体摩尔体积,错误;C.醋酸是弱酸,在溶液中只有很少以部分发生电离,因此在常温下,0.1 mol/L醋酸溶液的pH大于1,错误;D.在标准状况下,22.4L氯气的物质的量是1mol,它与足量氢氧化钠溶液反应,转移的电子数为NA,错误。
考点:考查物质的量的有关计算的知识。
本题难度:一般
5、选择题 溶质相同、质量分数为a%和b%的两份溶液质量分别为mg、ng,将两份溶液混合并蒸发去xg水,所得溶液的物质的量浓度为c mol/L。关于求溶质的摩尔质量,下列说法正确的是(?)
A.只要知道蒸发后所得溶液的密度(ρ),就能求出溶质的摩尔质量
B.只要知道混合前两份溶液的物质的量浓度(c),就能求出溶质的摩尔质量
C.只要知道蒸发前混合液的体积(V),就能求出溶质的摩尔质量
D.以上说法都不正确。
参考答案:
D
本题解析:
混合液中的溶质如果是易挥发或分解的,就无法求出溶质的摩尔质量。
本题难度:一般